

- 您好,欢迎您访问成贯仪器官方网站!


由于许多常见荧光团表现出的非常宽的带宽和不对称的光谱分布,荧光发射的渗透(通常称为交叉或串扰)是一个基本问题,必须在宽场和激光扫描共聚焦荧光显微镜中解决。这种现象通常表现为在光电倍增管通道中检测到一种荧光团的发射或通过为第二个荧光团保留的过滤器组合。渗透伪影通常会使实验结果的解释复杂化,特别是如果正在研究荧光团的亚细胞共定位或需要定量测量,例如共振能量转移 (FRET) 和光漂白 (FRAP) 研究。
除非荧光团的光谱分布非常好,否则具有两个或多个荧光标记(或表现出高度自发荧光的植物组织切片)的成像样本通常会因荧光发射的渗漏或交叉而变得复杂。例如,当使用传统的绿色和红色探针、荧光素和罗丹明进行双重标记时,只能通过使用优化的荧光滤光片组(和/或光电倍增管检测器狭缝宽度)来减少渗漏,但从未完全消除。这种效果是由于这些染料具有非常宽的吸收和发射光谱,表现出显着程度的重叠。因此,使用 488 nm 激光激发荧光素也会激发罗丹明,尽管程度较低。此外,荧光素发射将在光电倍增管通道或为罗丹明保留的宽场过滤器组中检测到。
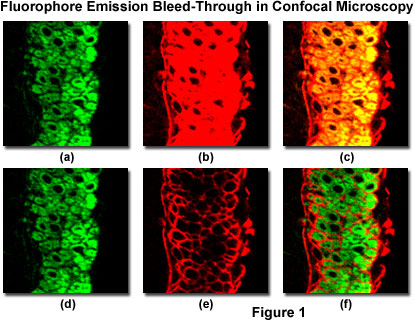
图 1 说明了用 Alexa Fluor 488 和 Cy3(一种花青染料)标记的小鼠肠道薄切片中的光谱渗漏,并用具有可调光电倍增管检测器狭缝的激光扫描共聚焦显微镜成像。这些荧光团显示吸收和发射光谱类似于荧光素和罗丹明,但峰值波长略有不同,带宽略窄。图 1(a) 和 1(b) 中所示的这对图像是通过使用 488 nm 激光(图 1(a))和 543 nm 激光(图 1(b))同时横向扫描样品获得的。注意 Cy3 检测通道中明显的 Alexa Fluor 488 荧光渗漏(图 1(b)),在最终合并图像中表现为黄色重叠区域(图 1(c))。这种伪影很容易与荧光团的共定位混淆。通过使用单独的激光器依次扫描样品并检测每个通道中的荧光以与激光照明相一致(图 1(d) 和 1(e);下面将详细讨论),光谱渗透被最小化(比较图 1( c) 到图 1(f)) 以生成更准确的荧光团分布合并图像。
Alexa Fluor 488 检测通道(参见图 1(a) 和 1(d))光电倍增管狭缝已设置为 30 纳米带宽(范围从 500 到 530 纳米),包含初级探针发射峰,但不捕获来自 Cy3 发射的大量荧光。因此,无论仪器是同时扫描还是顺序扫描,Alexa Fluor 488 通道在正常电压和增益设置下都不会检测到 Cy3 荧光发射。相比之下,为了从花青染料中捕获足够的荧光发射,Cy3 检测通道光电倍增管狭缝必须设置为更宽的范围(555 到 625 纳米),这也允许更长波长的 Alexa Fluor 488 发射在检测器上注册。因此,单独调整检测器狭缝(或干涉滤光片)不会充分减少具有这种高度光谱重叠的荧光团的渗透。在许多情况下,可以通过明智地选择具有良好分离的吸收和发射光谱的荧光团来控制渗漏。在这种情况下,用 Alexa Fluor 568 代替 Cy3(发射峰值波长有 35 纳米的差异)会导致 543 nm 激光的激发效率略低,但会显着减少渗透。
在双色标记实验中可能有用的一系列 Alexa Fluor 染料组合的光谱重叠比较如图 2 所示。所有发射光谱都经过归一化以进行比较,重叠区域用灰色阴影表示。在图 2(a) 中,绿色荧光 Alexa Fluor 488 和黄橙色荧光 Alexa Fluor 555 的发射光谱表明峰值波长的清晰分离,这也很容易被人眼区分。然而,中等水平的光谱重叠(灰色阴影区域)表明 Alexa Fluor 488 在 Alexa Fluor 555 的峰值发射波长处有大量发射(由从发射峰到横坐标的黑线表示) . 在 Alexa Fluor 488 的荧光发射强度明显高于 Alexa Fluor 555 的情况下,这种高水平的信号渗漏使得探针的分离变得困难,这可能是由于多种因素造成的,包括标记靶标的巨大差异人口。这些探针被 488 nm 和 543 nm/561 nm 激光有效激发。
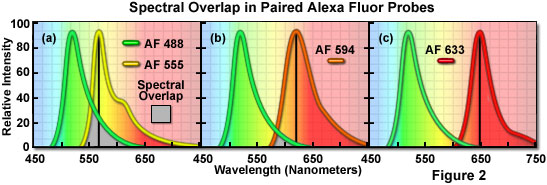
Alexa Fluor 探针之间的光谱重叠随着发射最大值之间的带宽增加而减少,如图 2(b) 所示。在这种情况下,与图 2(a) 相比,Alexa Fluor 488 和橙色荧光 Alexa Fluor 594 的重叠水平降低。两种染料很容易被人眼区分,并且在双标记实验中,如果每个探针的浓度相似,那么在双标记实验中,低程度的光谱重叠应该会产生良好的结果,并且渗漏最少。Alexa Fluor 594 被 561nm 二极管激光器或 594nm 二极管激光器最有效地激发。可见光发射 Alexa Fluor 染料的最佳光谱分离也许是图 2(c) 中描绘的 Alexa Fluor 488 和 Alexa Fluor 633 之间的比较。
在描述频谱重叠伪影时,术语渗透、交叉和串扰经常互换使用。虽然渗漏和交叉是指荧光发射(或激发)从一个滤光片组或光电倍增管检测通道溢出到另一个滤光片组,但串扰在滤光片行业中被广泛使用,以描述串联放置的两个滤光片的最小衰减水平。在匹配一组中的荧光激发、发射和二色分束器滤光片时,固定滤光片组合的串扰值对于制造商很重要,但与共聚焦显微镜中的光谱渗漏有些不同。因此,在选择一个术语来描述从一个检测器通道到另一个检测器通道的荧光发射的重叠时,应谨慎使用,调查人员应注意术语的差异。
在共聚焦显微镜中常用的合成荧光团和荧光蛋白的激发和发射过程中,可能会发生光谱交叉。通常,荧光团吸收(或激发)光谱分布之间的交叉发生在光谱的蓝色端(较短波长),而荧光发射光谱之间的交叉发生在红色(较长波长)区域。例如,绿色荧光团的发射通常可以通过红色发射滤光片检测到,但红色染料很少通过绿色发射滤光片成像。这是因为大多数染料的吸收和发射光谱并不对称,但通常会显示覆盖数十至数百纳米区域的长而倾斜的尾部。吸收光谱通常偏向较短波长,而发射光谱偏向较长波长。出于这个原因,多色荧光成像应首先使用最红(最长波长峰值发射)染料成像,使用仅被蓝色染料的偏斜光谱尾部吸收最少的激发波长。
减少渗出的标本标记预防措施
为了确定物理和空间位置,以及感兴趣的生物分子和亚细胞结构之间的关联,用两个或多个探针标记标本是荧光显微镜中的一种高效技术。在这方面,共聚焦显微镜(当使用两个或多个激光器时)非常适合多种标记技术,因为它能够通过将信号引导到多个检测通道来区分单个荧光团的荧光发射光谱。然而,在使用共聚焦或传统的宽场荧光显微镜进行多次标记实验时,必须考虑许多限制。
常见荧光团的荧光发射光谱曲线在带宽、峰值发射波长、对称性和最大值数量方面存在显着差异。在多标记的样本中,如果标记的程度和荧光团的荧光发射强度不均衡,则较亮的信号可能会压倒并穿透为较弱荧光团或目标丰度较低的通道保留的屏障过滤器。结果往往是过度染色的荧光团对为较低强度探针保留的通道中记录的图像有显着贡献。荧光素和罗丹明(以及它们的亲戚)等探针的荧光强度应该相似,并根据样品中染料的数量和照明源进行调整。
在样品制备过程中,不能过分强调荧光团发射的仔细平衡。在成像过程中,可以通过改变共聚焦显微镜中各个检测通道的增益、光电倍增管电压或激光功率来调整表观平衡。然而,在样品制备过程中简单地平衡荧光团的数量和颜色与目标丰度将缓解成像时的许多问题,并且通常会产生出色的图像。对于使用荧光素和罗丹明的双标记情况,图 3 说明了这一概念(仅提供了荧光发射光谱)。每个检测通道窗口都用图 3 中的彩色框勾勒出轮廓,荧光素通道收集信号在 490 到 555 纳米(红色框)之间,罗丹明通道设置为 570 到 665 纳米(蓝色框)的范围。请注意,罗丹明通道具有明显更宽的带宽,以便从发射光谱的偏斜长波长尾部区域收集信号。
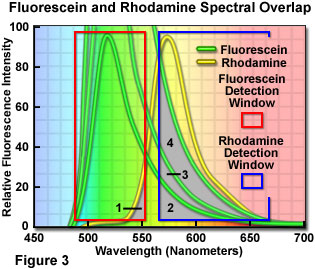
如果荧光团浓度平衡,使得两个荧光团产生相似的发射强度,那么从一个通道到另一个通道的渗漏量显示为图 3 中标记为1和2的灰色重叠区域。显然,显着更高的水平荧光素发射穿过罗丹明通道,反之亦然。在这种情况下,可以通过降低荧光素浓度同时保持罗丹明浓度不变来降低渗出程度。在荧光素标记水平大大超过罗丹明的情况下,渗出量变得更加严重,如标记为3和4 的区域重叠的增加所示(请注意,荧光素的浓度分别是两倍和四倍)。在图 3 所示的最高荧光素浓度下,在罗丹明通道中收集的渗漏发射量(区域4)几乎等于目标荧光团发射本身的量。
在为多标记标本选择荧光探针时,应为丰度最低的细胞靶标保留最亮和最耐光的荧光团。通常,具有绿色和红色荧光发射的染料往往比在光谱的蓝色和远红色部分发射的染料更亮。然而,即使在量子产率、光稳定性、照明源和目标丰度方面仔细控制探针浓度,信号交叉和渗透的水平通常仍保持在 10% 到 15% 之间,除非发射光谱最大值相隔 100 到 100 150 纳米或更多。此外,局部环境显着影响荧光团吸收和发射光谱曲线,因此,溶液中分离荧光团的制造商发布的光谱可能与在实际实验条件下观察到的光谱明显不同。在涉及两个或多个荧光团的实验中,研究人员应始终使用其他荧光团的过滤器组检查单染色对照样本,以确保渗漏水平最低。在许多情况下,渗透的主要原因是荧光团染色不均,应通过改变染色方案而不是调整显微镜中的曝光时间或通过采集后处理进行广泛的图像修复来纠正这种情况。研究人员应始终使用其他荧光团的过滤器组检查单染对照样本,以确保渗漏水平最低。在许多情况下,渗透的主要原因是荧光团染色不均匀,应通过改变染色方案而不是调整显微镜中的曝光时间或通过采集后处理进行广泛的图像修复来纠正这种情况。研究人员应始终使用其他荧光团的过滤器组检查单染对照样本,以确保渗漏水平最低。在许多情况下,渗透的主要原因是荧光团染色不均匀,应通过改变染色方案而不是调整显微镜中的曝光时间或通过采集后处理进行广泛的图像修复来纠正这种情况。
荧光团发射分离的仪器方法
传统的荧光素和罗丹明荧光团,以及它们的 Alexa Fluor 和花青染料亲属,是广域和共聚焦荧光显微镜中双重标记的流行组合。事实上,荧光素和罗丹明探针已被广泛使用,以至于大多数显微镜和售后市场过滤器制造商都有专门的过滤器组,以其反应性异硫氰酸酯中间体(分别为FITC 和 TRITC)命名。配备 LED 光源的宽场显微镜通常使用 470 和 550 纳米光谱峰激发这些荧光团,而共聚焦显微镜分别使用 488 nm 和 543 nm/561 nm 二极管激光器。
选择两个或多个荧光团以通过单个激光波长同时激发对实验参数施加了严格的限制。荧光团吸收光谱必须显着重叠以允许同时激发,但对于大多数组合,一种荧光团的激发程度远高于其他荧光团。此外,发射光谱应具有最小程度的重叠,以便通过精心选择的带通滤波器有效分离来自每个荧光团的信号。此外,具有最短激发波长的荧光团的发射光谱不应与其他荧光团的吸收光谱重叠,以避免能量转移伪影。由于这些严格的要求,以及普遍缺乏合适的荧光团,
宽场显微镜和共聚焦显微镜都使用由镀膜玻璃或多个薄膜干涉层构成的滤光片来分离荧光发射信号。在这些仪器中,二色分束器将光分流到两条路径,一条反射到样品上,另一条传输到检测器。带通屏障或发射滤光片在分束器传输的光被检测器收集之前对其进行细化处理,检测器可以是电荷耦合器件 (CCD)) 或光电倍增管。二色镜和屏障过滤器执行限制激发光到达检测器并收集来自单个荧光团的最大量发射信号而不允许来自其他荧光团的发射污染信号的功能。因此,荧光发射的分离高度依赖于滤光片特性。间隔良好和/或过宽的发射光谱轮廓可以利用覆盖一百纳米或更多的宽带通发射滤光片,并且由于通过滤光片的高水平荧光信号而产生明亮的图像。这些高信号水平可以通过在宽场荧光中使用中性密度滤光片或通过降低共聚焦显微镜中的激光功率来控制。相比之下,紧密重叠的发射光谱曲线需要非常窄的带通滤波器才能实现最佳分离,但代价是信号电平较低。
使用滤光片组检测荧光发射的主要缺点是滤光片收集的所有光子都以相同的方式处理,无论来源如何。不需要的波长通过一个典型的过滤器组的传输通常是通过的光子总数的 10% 左右。为了解决这个难题,共聚焦制造商正在开发多光谱仪器,能够根据单个荧光团的光谱分布来区分荧光发射源(这种技术通常称为发射指纹识别))。这些先进的仪器设计可能会成为现代共聚焦显微镜的主力军,它们利用几种可用选项中的一种或多种来区分实验中的发射,在这些实验中,选择非重叠荧光探针是不可能或不可行的。多光谱成像中最简单的方法是使用精细排列的色散光栅将荧光发射分解为其分量波长,并使用可移动狭缝将收集限制到特定区域。第二种方法使用棱镜或声光偏转器代替色散光栅来执行相同的功能,而第三种设计将色散光栅耦合到多通道光电倍增管,该光电倍增管收集一系列窄(10 纳米)波段。
多光谱共聚焦显微镜是在单个实验中对多种荧光蛋白变体成像或自然发生和固定剂诱导的荧光(通常统称为自发荧光)时的首选方法 ) 掩盖了目标荧光团的信号。自发荧光和其他形式的不需要的发射信号通常会交叉到多个通道中,这是一个使定量分析复杂化的因素。此外,当在一个实验中使用四个或更多荧光团时,显着程度的光谱重叠以及由此产生的渗色伪影是不可避免的。在这种情况下,多光谱成像是消除渗色最有前途的技术之一。多光谱成像的缺点之一是伴随着分离荧光发射通常需要的窄检测窗口的信号减少。另一种消除渗透的仪器方法(称为荧光寿命成像显微镜,或 FLIM)是基于 门控 寿命研究中的荧光输出,其中具有相似光谱轮廓的荧光团可以由于其各自的衰减特性而被区分。
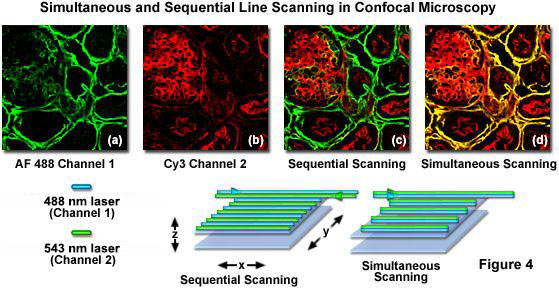
配备声光可调滤光片 (AOTF) 或类似的快速激光线切换装置的共聚焦显微镜可以有效地利用一种称为高速通道切换或多跟踪的技术来顺序扫描样品.这种方法可以连续激发和收集来自单个荧光团的发射,以减少或消除渗透,但当发射和吸收光谱广泛重叠时,不能解决问题。在实践中,激光线的快速切换,无论是单独的还是整个帧的,都与每个通道的串行检测相结合,因为其目标荧光团受到刺激(见图 4)。对于图 4 中所示的示例,使用 Alexa Fluor 488 和 Cy3,用于激发 Alexa Fluor 488 的 488 纳米激光线在激光扫描x 中的线时打开 -方向,同时使用通道检测器的适当过滤器集收集 Alexa Fluor 488 发射。在返回路径上,488 纳米线被关闭,样品中的 Cy3 探针被 543 纳米激光线激发,再次使用 Cy3 兼容滤波器组为第二个通道检测器仅收集荧光发射。这种扫描顺序避免了同时激发两种荧光团,是一种控制渗漏的有效方法,特别是当发射滤光片的选择有限时。
对每个单独通道同时收集荧光信号的顺序帧扫描是一种极好的方法,可以用固定的固定样本生成非常漂亮的图像。然而,当从标记有两个或多个荧光团的活细胞中收集图像时,即使亚细胞结构的小幅度运动也会影响图像并降低共定位研究的准确性。因此,对于活细胞研究,使用快速多轨线扫描在单个激光线之间快速切换更为谨慎,在记录帧时一次为每个通道收集一条线的图像信息。
荧光蛋白的渗透
荧光蛋白在从蓝色到远红色的发射波长范围内广泛使用,对于使用共聚焦显微镜的活细胞成像研究非常有效,尽管有一些权衡。例如,当实验中使用两种以上的物种时,数据采集率会降低,并且每种荧光蛋白通常需要截然不同的图像采集条件。与传统的合成探针相比,解决荧光蛋白的光谱渗漏问题通常要复杂得多,尤其是因为前者的发射光谱往往非常宽泛。此外,由于不同荧光蛋白的相对亮度不同,每种颜色可能需要不同的信号积分时间。增强的青色和蓝色品种(ECFP和EBFP) 与绿色和黄色荧光蛋白相比非常暗淡,需要更长的收集时间才能使更亮的荧光团饱和。因此,在使用荧光蛋白时,实验要求必须与荧光团的选择相平衡,以确定具有相似发射强度和分离良好的光谱特征的组合。
一些最亮的荧光蛋白是绿色和黄色的,但由于它们的光谱峰仅相距 25 纳米,因此很难成功区分这些物种。使用绿色和黄色荧光组合进行双色或多色实验是可能的,但滤光片组之间的渗透和/或从根本上减少检测狭缝带宽的必要性是一个重大问题。更常见的是,黄色荧光蛋白与青色荧光蛋白结合用于双色成像实验。虽然青色荧光蛋白并不比蓝色物种亮多少,但它有两个优点,即可以用 445nm 激光激发,并且比蓝色荧光蛋白更耐光漂白。
DsRed 与绿色或黄色荧光蛋白的组合也产生足够的光谱分离,但生物制品,如缓慢成熟和聚集体形成,通常使红色荧光蛋白种类的研究复杂化。第二代红色荧光蛋白解决了生物学问题,为多标记实验提供了极好的候选物。许多荧光蛋白的发射曲线延伸到远红和近红外,使研究人员能够利用红色 640 纳米二极管激光线。通过将更进一步位移的红色染料与近红外二极管激光器(例如 730 纳米和 785 纳米激光器)结合使用,可以实现进一步的光谱分离。流行的远红染料的例子包括 Cyanine7、Alexa Fluor 750、Alex Fluor 790 和 Indocyanine Green (ICG)。

量子点
量子点是涂有亲水聚合物壳并与抗体或其他生物活性部分结合的半导体纳米晶体,具有大多数传统荧光团不具备的几个优点。与典型的有机荧光染料或荧光蛋白不同,它们显示出高度明确的光谱曲线,量子点的吸收光谱随着波长的减少而稳步增加。与此相反,荧光发射强度被限制在一个对称峰值,最大波长取决于点的大小,但与激发波长无关。因此,无论量子点是在 300、400、500 还是 600 纳米激发,都观察到相同的发射轮廓,但荧光强度在较短激发波长下显着增加。例如,当半导体在 400 与 600 纳米激发时,在橙色区域(605 纳米)发射的典型量子点共轭物的消光系数大约高 5 倍。典型量子点共轭物的半峰全宽约为 30 纳米,并且光谱分布不偏向更长的波长(具有更高强度的“尾部”),大多数有机荧光染料就是这种情况。窄的发射剖面使几个量子点共轭物能够以最小的渗漏水平同时被观察到。典型量子点共轭物的半峰全宽约为 30 纳米,并且光谱分布不偏向更长的波长(具有更高强度的“尾部”),大多数有机荧光染料就是这种情况。窄的发射剖面使几个量子点共轭物能够以最小的渗漏水平同时被观察到。典型量子点共轭物的半峰全宽约为 30 纳米,并且光谱分布不偏向更长的波长(具有更高强度的“尾部”),大多数有机荧光染料就是这种情况。窄的发射剖面使几个量子点共轭物能够以最小的渗漏水平同时被观察到。
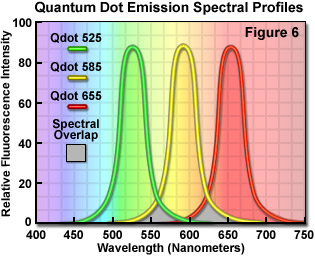
在共聚焦显微镜中,大多数激光线以不同程度的效率激发量子点。在紫外线和紫色区域激发量子点特别有效的是蓝色二极管激光器,它们在 445 纳米及以下具有显着的谱线。405 纳米蓝色二极管激光器是一种常见的激发源,由于量子点在该波长下具有高消光系数,因此非常适合与量子点一起使用。在共聚焦显微镜中使用这些荧光团的另一个优势是能够用单一激发波长在同一样本中激发多种量子点尺寸(和光谱颜色),使这些探针成为多种标记实验的绝佳候选者。量子点的发射最大值以 20 至 40 纳米的增量从 525 纳米延伸至 705 纳米,以及具有以 800 纳米为中心的发射峰的近红外探针。通过仔细选择合适的量子点组合(例如,525、585 和 655;参见图 6),与传统荧光团相比,可以使用单个激光进行共聚焦实验并显着减少渗出伪影。
渗透修正
由于多标记实验中的荧光信号数量很容易超过检测系统的识别能力,无论仪器的复杂程度如何,采集后图像处理通常是渗漏校正的唯一替代方法。使用两个或多个荧光团进行多次标记时,应准备一系列对照样本,以尽量减少由于渗透伪影造成的实验结果混淆。最重要的对照是制备不含二抗或合成荧光团的样本(背景对照),并分别用每个荧光团标记样本(渗透对照)。应使用每个激光和检测通道独立检查背景控制,以设置应用于最终成像系列的信号增益和偏移的限制。将用于对多标记样本进行成像的所有通道都必须进行独立的背景校正,因为每个通道中的自发荧光水平可能会有很大差异。通常,对于较短的激发波长,例如紫外线、405 纳米和 488 纳米激光器发出的波长,自发荧光更大。绿色、黄色、橙色和红色激光通道不太容易出现自发荧光伪影。
要确定每个通道中可能的信号增益量,而不会启动到相邻通道的渗漏,渗漏控制是必要的。例如,在检查双标记的荧光素和罗丹明标本时,应制备同时含有荧光素和罗丹明的标本。为了确定渗透水平,荧光素对照在最佳条件下用氩离子 488 纳米激光成像,并记录罗丹明通道中存在的信号量(注意样本中没有罗丹明染料)。该信号代表结合背景自发荧光的荧光素渗出。用罗丹明对照重复该过程,这一次用 543 nm/561 nm 线激发并检查渗入荧光素通道的情况。
这种渗透校正方法要求荧光发射强度和荧光团浓度之间的关系对于图像中的所有像素都是恒定的。用于共聚焦显微镜的光电倍增管在单波长成像时表现出良好的线性,但由于光电倍增管量子效率与检测光波长之间的高度非线性关系(特别是在响应曲线的极值)。此外,必须考虑局部环境变量和被检查区域中光漂白的影响。荧光团发射光谱波长分布的变化,尽管大多数流行的探针不太可能,
一旦准备好并分析了适当的对照,就可以估计目标样本中的荧光团对成像时可能发生的信号渗漏量。如上所述,即使采用滤波器带宽优化,一部分荧光素发射也会渗入罗丹明通道,而一些罗丹明发射将渗入荧光素通道,尽管罗丹明的渗出会比用荧光素观察到的少得多。有几个商业软件包可用于使用线性分解处理渗出数据算法和共聚焦显微镜制造商通常将类似的软件与他们的仪器捆绑在一起。该软件可以对图像中的每个像素应用联立线性方程校正算法,以确定基于样本和控件记录的强度比的渗色量。
光谱渗透伪影很容易与共振能量转移、共定位和非特异性背景染色混淆。如果一个荧光团的发射光谱与第二个探针的吸收光谱显着重叠,则两个荧光团共定位的区域可能会发生共振能量转移。如上所述,通过对单独用单个荧光团标记的样本进行控制测量,可以将渗漏与共振能量转移区分开来。通过激发具有最低吸收最大值的荧光团,然后检测其发射光谱与激发探针重叠的荧光团通道中的信号,可以观察共振能量转移(在渗漏校正后)。以荧光素和罗丹明为例,用 488 纳米激光激发荧光素后,在罗丹明通道中监测荧光。罗丹明通道中记录的任何信号都可能是由于共振能量转移,但仅限于两个探针共定位的区域。
结论
总之,用于共聚焦或宽场荧光显微镜的最佳荧光团具有与用于激发探针的激光或 LED 光谱线紧密匹配的吸收最大值。为丰度最低的目标选择具有最高量子产率的荧光团将有助于平衡整体荧光发射。此外,具有窄发射光谱的探针可能会显着减少渗透问题,但不会完全消除它。选择用于检查荧光团发射的滤光片组应在带宽大小和位置方面与探头的光谱轮廓紧密匹配。此外,干扰滤光片的阻挡水平通常因制造商而异,应进行检查以确保用于成像的滤光片组排除了不需要的荧光发射。
现代合成荧光团对光漂白的敏感性显着降低,这使得与 CCD 相机的集成时间更长或光子收集时间更长,同时降低了共聚焦显微镜中的激光功率。这导致在活细胞成像实验中获得更高质量的图像和更少的细胞损伤。与合成荧光团相比,现代荧光蛋白比以前的版本更耐光,并且比合成探针更可能不破坏细胞代谢过程。然而,应该注意的是,所有荧光团都有可能在一定程度上影响细胞行为,特别是如果探针的化学和物理特性因环境变量(如离子浓度、pH 值和疏水性)而显着改变。
无论荧光团的物理特性如何,都需要高度的目标特异性才能获得合适的信号水平并减少渗透伪影,尤其是在免疫荧光制剂中使用二抗时。即使是少量的非特异性标记也会产生高度的背景,这会降低样本图像并混淆定量解释。许多旨在突出亚细胞结构(例如高尔基复合体或线粒体)的探针具有相对较低的特异性,但由于这些细胞器的已知几何结构,它们仍然有用。
随着制造商开发更先进的荧光团并在整个可见光和近红外区域扩展二极管激光线,在无渗色伪影的共聚焦和宽视场荧光显微镜中为多个标记实验选择探针将变得更加容易。例如,配备 405 纳米二极管激光器、514 纳米二极管激光器和 640 纳米红色二极管激光器的共聚焦显微镜可以激发具有最大波长间隔超过 100 纳米的发射光谱的荧光团,从而最大限度地减少渗透的可能性-通过。此外,具有远红色和红外线发射光谱的新型荧光蛋白将需要红移激光线,与紫色、蓝色和绿色系统相比,这种激光线对细胞代谢过程的破坏性更小。