

- 您好,欢迎您访问成贯仪器官方网站!


当有机或无机的活体或非活体标本吸收并随后再发光时,该过程被描述为光致发光。如果在激发能量(光)停止后光的发射持续长达几秒钟,则该现象被称为磷光。另一方面,荧光描述了仅在吸收激发光期间持续的光发射。激发光的吸收与荧光再发射光之间的时间间隔非常短,通常小于百万分之一秒。
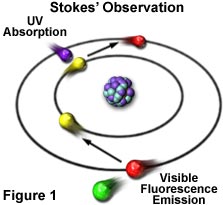
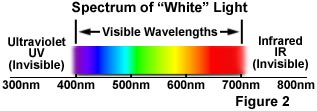
荧光现象在十九世纪中叶就已知了。英国科学家乔治·斯托克斯爵士(Sir George G. Stokes)首先提出了这样一个观察:矿物萤石在被紫外光照射时表现出荧光,他创造了“荧光”这个词。斯托克斯观察到,荧光灯的波长比激发光的波长长,这种现象已经成为斯托克斯位移。在图1中,一个紫外线(紫色)的光子与一个简单原子中的电子碰撞,激发和提升电子到更高的能级。随后,激发的电子松弛到较低的水平,并在可见光区域以较低能量的光子(红色)的形式发光。图2是电磁辐射的可见光区域的示意图,该电磁辐射涵盖从约400至700纳米的波长范围。可见光区域周围是较高能量的紫外光和较低能量的红外光。
荧光显微镜是一种很好的研究材料的方法,可以以天然形式(称为主要或自发荧光)或用能够发荧光的化学物质(称为次要荧光)处理时发出荧光。荧光显微镜是由二十世纪早期的八月克勒,卡尔赖克特和海因里希莱曼等人设计的。然而,这种仪器的潜力几十年来没有实现,荧光显微镜现在是细胞生物学中一个重要的(也许是不可缺少的)工具。
早期的调查显示,许多标本,包括微量矿物质,晶体,树脂,生药,黄油,叶绿素,维生素和无机化合物,表现出紫外线照射自体荧光。然而,直到20世纪30年代,奥地利研究人员Max Haitinger和其他科学家开发了二次荧光技术,该技术使用荧光染料标记特定的组织成分,细菌和其他不自发荧光的病原体。这些荧光染料标记到特定的生物化学目标,激发了荧光显微镜的使用。在二十世纪五十年代,当Albert Coons和Nathan Kaplan证明抗原在与荧光素标记的抗体反应的组织中定位时,仪器的值显着增加。
荧光显微镜的基本任务是允许激发光照射样品,然后从较亮的激发光中分离较弱的发射荧光。因此,只有来自标本的发射光到达眼睛或其他检测器(通常是数字或传统胶片相机)。所产生的荧光区域在黑暗背景下明亮地照射,具有足够的对比度以允许检测。无荧光材料背后的背景越黑暗,仪器的效率越高。
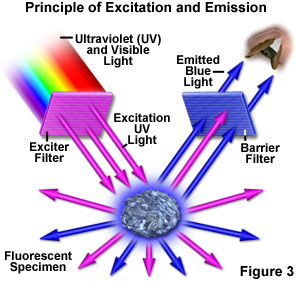
图3表示荧光显微镜观察荧光标本时的发生情况。紫外线(UV)通过使来自紫外发射源的光通过激励滤波器而产生特定波长或波长组。被过滤的紫外光照射样品,在这种情况下是萤石晶体,当紫外光照射时,萤石发射荧光。从样品发出的可见光(图3中的红色)然后通过不允许反射的紫外光通过的屏障过滤器进行过滤。应该指出,这是显微镜的唯一模式,其中样品在激发之后产生自己的光。无论激发光的方向如何,发射的光线都会在所有方向上(360度角)重新发射。
荧光显微镜是一个迅速扩大和无价的调查工具。其优点是基于其他光学显微镜技术中不易获得的属性。荧光染料的使用使得有可能在非荧光物质中以高度特异性鉴别细胞和亚微观细胞组分和其他实体。更重要的是,荧光显微镜可以揭示荧光物质的存在,并具有极高的灵敏度。可以检测极少量的荧光分子(每立方厘米少至50个分子)。在给定的样品中,通过使用多重染色,不同的探针将揭示个别靶分子的存在。
荧光显微镜技术可应用于有机材料,以前的生物(生物)材料,或活体材料(使用体外或体内荧光染料)或无机材料(特别是在调查半导体晶圆上的污染物) 。还有一些研究使用荧光探针来监测快速变化的生理离子浓度,如钙和镁,以及活细胞中的pH值。
许多植物和动物组织以及材料样本在用较短波长的光照射时(初级或自发荧光)固有地发荧光。自发荧光在植物研究,煤岩学,沉积岩石岩石学和半导体工业中被发现有用。在动物组织或病原体的研究中,自发荧光常常是非常微弱的或者非特异性的,以使得自发荧光的最小效用。对于这样的标本来说,更大的价值是通过照射光而激发的外在荧光染料(也称为荧光团),并且其发射光的最终产量具有更大的强度。这种荧光称为二次荧光。
荧光染料是有点类似于更为人所知的可见光吸收组织污渍,它们自身附着在可见或不可见的有机物上。这些能够吸收并随后再辐射光的荧光染料在其附着靶向中通常是高度特异的,并且在吸收 - 发射比(称为量子产率的概念)方面具有显着的产量。这使得荧光色素在生物应用中非常有价值。荧光显微镜使用的增长与数百种具有激发(吸收)和发射的强度曲线以及广为人知的生物结构目标的荧光染料的发展密切相关。
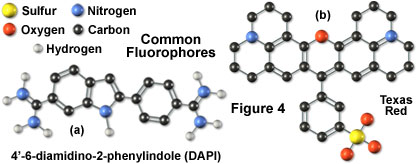
图4所示是荧光显微镜中最常用的两种荧光染料。流行的核酸染色剂4',6-二脒基-2-苯基吲哚(DAPI)(图4中的左侧分子)是以两个高亲核性脒基部分为特征的吲哚衍生物,其可用于荧光标记核酸,在荧光分析中被广泛应用于病原体的快速鉴定。最初作为潜在的抗锥虫剂合成,DAPI优先结合腺苷和胸苷(AT)碱基对区域,并被最大吸收波长为355纳米的紫外光激发。染料在可见光谱的蓝色区域发出荧光。在DAPI分子的右侧(图4)是另一种荧光染料德克萨斯红,其荧光共轭物的性质已被彻底研究。这种荧光染料被开发用于流式细胞仪应用中的双重标记,但广泛用于代替罗丹明(另一种常见荧光染料)用于荧光显微镜中的抗体检测。
在许多情况下,德克萨斯红与DAPI和异硫氰酸荧光素(FITC)结合用于多染色的样品,由于染料的红色,蓝色和绿色荧光可以观察到。当决定使用哪种标记进行荧光显微镜检查时,必须牢记,所选择的荧光染料应该具有很高的吸收激发光的可能性,并且应该保持与目标分子连接。荧光染料还应该能够提供令人满意的发射荧光的产量。
荧光显微镜最重要的应用之一是在免疫荧光领域。活体动物制造无数抗体,与白细胞一起使用,以中和任何进入的含有或产生抗原的病毒,细菌和外来蛋白质等异物。抗原抗体反应是高度特异性的,通常被比喻为锁定和关键的关系。免疫荧光的成功在于荧光显微镜的灵敏度和免疫学所表现的高度特异性之间的联系。
在直接免疫荧光中,特异性抗体通过化学附着荧光物质以形成所谓的缀合物来标记,然后将其涂布在含有已知刺激抗体产生的特定抗原的疑似存在的显微镜载玻片上。如果存在抗原,那么标记的抗体缀合物结合抗原并在洗涤之后保持与样本结合。当荧光染料在其激发峰处被激发时,化学连接的荧光缀合物和抗原的存在被证实,然后可以目视观察或者由检测器系统(数字或传统照相机)捕获随后的各种波长的发射强度。
另一种常用的技术被称为间接技术免疫荧光,其中可能含有未标记的抗体及其相关但已知的抗原的血清一起温育。然后将与抗人抗体缀合的荧光物质(如果被测试的样品是人的)置于含有未标记的抗体 - 抗原的载玻片上。如果确实存在抗原 - 抗体反应,则荧光染料标记的抗人抗体自身附着到由抗原和抗体形成的复合物上。随后,针对该荧光染料的峰值波长强度激发抗原,抗体和荧光染料标记的抗人抗体的标记分组,并且观察到任何产生的发射。间接免疫荧光技术降低了库存大量标记抗体的必要性,并且通常也导致更大的荧光强度。
荧光研究的一个重要领域涉及细胞化学和组织化学染色。荧光染料已被用于鉴定染色体,DNA含量,蛋白质,细胞结构,激素和维生素。荧光显微镜是一个强大的工具,在这样的研究中,由于精选的荧光染料的敏感性及其对样品中极微量的特异性。实际上,尽管荧光显微镜的空间分辨率受到数值孔径和衍射极限所控制的通常规则的限制,但荧光探针可以通过发射的光通过使这种材料即使在仅存在于子区域中时也可见而显示荧光材料的存在,分辨率量(如几个分子)。
荧光显微镜的新兴应用包括将荧光探针(荧光染料)应用于活体材料,体外(玻璃)和体内(生活)。由于可能的毒性限制,这些探针的困难倍增。另外,由于生命过程的不断变化和细胞内结构的运动,必须对时间间隔进行相当大的关注。荧光研究已应用于重要生物离子如氢(pH),钙和镁离子浓度的改变,结合和未结合。
其中最着名的是使用流行的荧光探针Fura-2对细胞内钙的研究。对于这种染料,可以在单个发射波长处监测大约340和380纳米(使用光斩波器和双激发滤波器或单色器)的双激发,其针对每个激发带独立测量。控制显微镜的主计算机用于计算比率(在称为比例成像的过程中)荧光)结合到游离的细胞内钙,如通过荧光发射强度的变化所揭示的。比例法的优点在于,除了双近紫外激发波长之外,基本上所有的因素都保持不变,每个波长都在可见光谱的绿色部分产生发射。使用称为Indo-1的探针进行类似类型的比率成像。对于这种也用于测定细胞内结合和非结合钙的荧光染料,使用单一激发波长,但是在两个波长的每一个波长处测量发射以区分结合的钙和未结合的钙。