

- 您好,欢迎您访问成贯仪器官方网站!


生物激光扫描共聚焦显微镜在很大程度上依赖于荧光作为成像模式,主要是由于该技术提供的高度灵敏度,以及在化学固定以及活细胞和组织中特异性靶向结构组分和动态过程的能力。许多荧光探针围绕合成芳香族有机化学物质构建,设计用于与生物大分子(例如,蛋白质或核酸)结合或定位在特定结构区域内,例如细胞骨架,线粒体,高尔基体,内质网和核。其他探针用于监测动态过程和局部环境变量,包括无机金属离子的浓度,pH,活性氧和膜电位。荧光染料还可用于监测细胞完整性(活细胞与死细胞和细胞凋亡),内吞作用,胞吐作用,膜流动性,蛋白质运输,信号转导和酶活性。此外,荧光探针已广泛应用于分子遗传学领域的遗传作图和染色体分析。
合成荧光探针的历史可以追溯到一个世纪到19世纪后期,当时开发了许多用于现代组织学的基石染料。其中包括pararosaniline,甲基紫,孔雀石绿,番红O,亚甲蓝和许多偶氮(氮)染料,如俾斯麦棕。虽然这些染料是高度着色的并且能够吸收选定的可见光带,但大多数只是微弱的荧光,并且对几十年后开发的荧光显微镜无用。然而,基于x吨和吖啶杂环系统在此期间合成的几种合成染料类别被证明是高度荧光的,并为现代合成荧光探针的开发提供了基础。
二十世纪初,荧光显微镜被引入荧光显微镜作为细菌,原生动物和锥虫的重要染色剂,但直到20世纪20年代荧光显微镜首次用于研究固定组织和活细胞中的染料结合时才被广泛使用。然而,直到20世纪40年代早期,Albert Coons开发出一种用荧光染料标记抗体的技术,从而产生了免疫荧光领域。在过去的60年中,免疫学和分子生物学的进步产生了广谱的二抗,并提供了针对大分子复合物中特定区域的荧光探针的分子设计的见解。
荧光探针技术和细胞生物学通过从水母中发现绿色荧光蛋白(GFP)和突变光谱变体的发展而显着改变,这为亚细胞蛋白定位,分子间相互作用的非侵入性荧光多色研究敞开了大门,使用活细胞培养物进行贩运 最近,开发了纳米级荧光半导体量子点为共焦和宽视场荧光显微镜研究提供了新的途径。尽管在过去几十年中荧光染料合成取得了许多进展,但关于开发新荧光染料的分子设计规则的确凿证据很少,特别是关于将吸收光谱与可用的共聚焦激光激发波长匹配。结果,在共聚焦显微镜中广泛使用的荧光团的数量是已发现的数千个的有限子集。
荧光团的重要特征
根据荧光团的吸收和荧光特性对荧光团进行编目和描述,包括光谱分布,最大吸收和发射的波长,以及发射光的荧光强度。用于表征吸收光谱的最有用的定量参数之一是摩尔消光系数(用希腊符号ε表示),见图2(a)),它是分子吸收光能力的直接量度。消光系数可用于将吸光度单位转换成摩尔浓度单位,并且通过测量在限定的光程长度内的摩尔浓度的参考波长(通常是吸收物质的最大值,特征)的吸光度来确定。荧光染料或荧光团的量子产率代表荧光发射效率的定量测量,并表示为发射的光子数与吸收的光子数之比。换句话说,量子产率代表给定的激发荧光染料产生发射(荧光)光子的概率。量子产率通常介于0到1之间,通常在显微镜中用作探针的荧光分子具有从非常低(0.05或更低)到几乎为1的量子产率。通常,在大多数成像应用中需要高量子产率。给定荧光团的量子产率随着环境因素(例如金属离子浓度,pH和溶剂极性)而变化,有时变为极端极端。
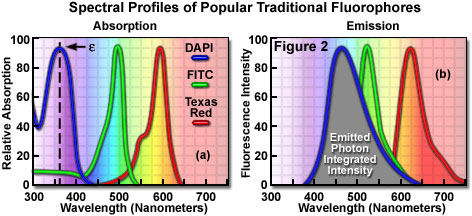
在大多数情况下,光子吸收的摩尔消光系数是在特定波长下定量测量和表示的,而量子效率则是对荧光团整个光谱带上的总积分光子发射的评估(见图2(b)) 。与在宽视场荧光显微镜中使用最短距离(10-20纳米)带通干涉滤光片的传统电弧放电灯相反,用于扫描共聚焦显微镜中的荧光团激发的激光系统将激发限制为仅包含少数几个的特定激光光谱线。纳米。然而,两种技术的荧光发射光谱由类似的带通或长通滤波器控制,其可以覆盖数十至数百纳米。低于饱和水平,荧光强度与摩尔消光系数和荧光团的量子产率的乘积成比例,该关系可用于判断作为激发波长的函数的发射的有效性。对于通常用于共聚焦显微镜研究的流行荧光团,这些参数显示出大约20倍的变化范围,量子产率范围为0.05至1.0,消光系数范围为一万至二十五万(升/摩尔)。通常,荧光团的吸收光谱远不如荧光发射特性(光谱波长分布和量子产率)对环境条件的依赖性。可用于判断作为激发波长的函数的发射有效性的关系。对于通常用于共聚焦显微镜研究的流行荧光团,这些参数显示出大约20倍的变化范围,量子产率范围为0.05至1.0,消光系数范围为一万至二十五万(升/摩尔)。通常,荧光团的吸收光谱远不如荧光发射特性(光谱波长分布和量子产率)对环境条件的依赖性。可用于判断作为激发波长的函数的发射有效性的关系。对于通常用于共聚焦显微镜研究的流行荧光团,这些参数显示出大约20倍的变化范围,量子产率范围为0.05至1.0,消光系数范围为一万至二十五万(升/摩尔)。通常,荧光团的吸收光谱远不如荧光发射特性(光谱波长分布和量子产率)对环境条件的依赖性。对于通常用于共聚焦显微镜研究的流行荧光团,这些参数显示出大约20倍的变化范围,量子产率范围为0.05至1.0,消光系数范围为一万至二十五万(升/摩尔)。通常,荧光团的吸收光谱远不如荧光发射特性(光谱波长分布和量子产率)对环境条件的依赖性。对于通常用于共聚焦显微镜研究的流行荧光团,这些参数显示出大约20倍的变化范围,量子产率范围为0.05至1.0,消光系数范围为一万至二十五万(升/摩尔)。通常,荧光团的吸收光谱远不如荧光发射特性(光谱波长分布和量子产率)对环境条件的依赖性。
选择用于共焦应用的荧光团必须具有足够的亮度水平和信号持久性,以使仪器获得不会遭受过度光漂白伪影和低信噪比的图像数据。在宽视场荧光显微镜中,使用中性密度滤光片可以轻松控制激发光照水平,并且可以降低强度(与更长的发射信号采集周期相结合)以避免饱和并减少不可逆的荧光损失。然而,共焦显微镜中的激发条件更严重几个数量级,并且由荧光团的特性和显微镜光学系统的效率所施加的限制成为决定激发速率和发射收集策略的主要因素。
| 资源 | 紫外线 | 紫色 | 蓝色 | 绿色 | 黄色 | 橙子 | 红 | 近红外 |
|---|---|---|---|---|---|---|---|---|
| 氩离子 | 351,364 | - | 457,477,488 | 514 | - | - | - | - |
| 二极管 | - | 405,440 | - | - | - | - | 635,640 | 650,685 |
| DPSS | 355 | 430,442 | 457,473 | 532 | 561 | 593 | 638 | 660,671 |
| 他镉 | 322,354 | 442 | - | - | - | - | - | - |
| 氪氩 | - | - | 488 | - | 568 | - | 647 | 676 |
| 氪离子 | - | - | - | - | - | - | 647 | 676,752 |
| 氦氖 | - | - | - | 543 | 594 | 612 | 633 | - |
| 水星弧 | 365 | 405,436 | - | 546 | 579 | - | - | - |
| 氙弧 | - | - | 467 | - | - | - | - | - |
| 金属卤化物 | 365 | 435 | 495 | 520,545 | 575 | - | 625 | 685 |
由于在共聚焦显微镜中用于激发荧光团的窄且波长受限的激光光谱线(参见表1),由于激发波长与荧光团吸收带的重叠不良,荧光发射强度可能受到严重限制。此外,共焦针孔光圈对于获得高信噪比的薄光学部分至关重要,无论在微调上花费了多少精力,都会造成25%到50%的发射强度损失。和显微镜光学系统的对准。光电倍增管是共聚焦显微镜中最常见的探测器,但受到随波长变化的量子效率的影响(特别是在红色和红外区域),进一步有助于发射光谱中波长相关的信号损失。共聚焦显微镜中的光损失可导致强度降低超过宽视场荧光仪器中通常观察到的水平的50倍。从前面的论证中可以清楚地看出,荧光团选择是共聚焦显微镜最重要的方面之一,并且必须仔细考虑仪器效率,以便产生高质量的图像。
在共聚焦显微镜中,用高功率密度的聚焦激光束照射荧光团使发射强度增加到染料饱和点,这是一种参数由激发态寿命决定的条件。在激发态,荧光团不能吸收另一个入射光子,直到它们通过荧光过程发射出较低能量的光子。当荧光团激发速率超过发射衰减速率时,分子变得饱和并且基态群体减少。结果,大部分激光能量通过样品不会减少,并且不会促进荧光团的激发。因此,平衡荧光团饱和度与激光强度水平是
目前可用于共聚焦显微镜的荧光探针的数量为数百个,其中许多染料具有与普通激光光谱线密切相关的最大吸收。特定激光线与特定探针的吸收最大值之间的精确匹配并不总是可能的,但是接近最大值的线的激发效率通常足以产生可以容易地检测到的荧光发射水平。例如,在图3中,示出了两个常见探针的吸收光谱,以及最有效的激光激发线。绿色光谱是异硫氰酸荧光素(FITC的吸收曲线)),最大吸收为495纳米。使用氩离子激光器在488纳米处激发FITC荧光团产生约87%的发射效率。相反,当使用477纳米或514纳米氩离子激光线来激发FITC时,发射效率分别降至58%或28%。显然,488纳米氩离子(或氪 - 氩)激光线是激发该荧光团的最有效来源。
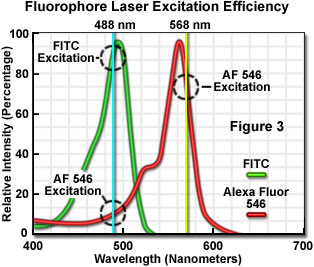
图3中的红色光谱是Alexa Fluor 546的吸收曲线,Alexa Fluor 546是一种双磺化脂环族x吨(罗丹明)衍生物,最大消光系数为556纳米,专门用于显着提高量子效率,同时显着降低光漂白水平。荧光实验。Alexa Fluor 546最有效的激光激发光谱线是来自氪 - 氩混合气体离子激光器的黄色568纳米线,其发射效率约为84%。接下来最接近的激光光谱线,来自绿色氦 - 氖激光器的543纳米线和来自黄色氦 - 氖激光器的594纳米线激发Alexa Fluor 546,效率分别为43%和4%。
仪器上,荧光发射采集可以通过仔细选择物镜,探测器孔径尺寸,二色和屏障滤光器以及保持光学系统精确对准来优化。在大多数情况下,应选择具有高数值孔径的低放大倍率物镜用于最苛刻的成像条件,因为光收集强度随着数值孔径的四次方增加,但仅随放大倍数的平方而减小。然而,共聚焦显微镜中光收集效率的最重要限制源于荧光团本身的物理性质所施加的限制。如前所述,荧光探针的发展受限于缺乏对产生最佳荧光特征的特定分子特性的了解,并且设计规则不足以理解为有助于开发更有效的荧光团。目前在共焦显微镜中具有令人满意的性能的新荧光探针的开发成功证明了通过使用经验数据和从现有染料的性质推断的分子结构的假设所取得的进展,其中许多首先合成超过一百个多年前。
传统荧光染料
用于共聚焦显微镜的荧光探针的选择必须解决该仪器的特定能力,以激发和检测由激光系统和检测器提供的波长区域中的荧光发射。虽然共聚焦显微镜中使用的电流激光器(见表1)在光谱的紫外,可见和近红外部分产生离散线,但这些光谱线的位置并不总是与流行荧光团的吸收最大值一致。事实上,激光光谱线不必与最大吸收的荧光团波长精确对应,但荧光发射的强度由激发波长处的荧光团消光系数调节(如上所述)。用于共聚焦显微镜的最流行的激光器是风冷氩和氪 - 氩离子激光器,新的蓝光二极管激光器和各种氦 - 氖系统。总的来说,这些激光器能够提供在4到12纳米之间的10到12个特定波长的激发。
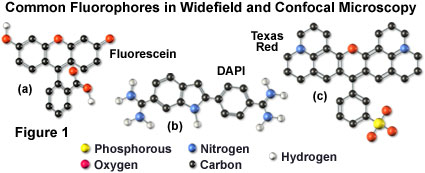
许多经典荧光探针已成功应用于宽视场荧光,包括异硫氰酸荧光素(见图1(a),图2和图3),丽丝胺罗丹明和德克萨斯红(图1所示结构)( c);图2中的光谱,也可用于共聚焦显微镜。荧光素是有史以来最受欢迎的荧光染料之一,在免疫荧光标记中有广泛的应用。这种x吨染料在495纳米处具有最大吸收(见图2(a)和图3),与氩离子和氪 - 氩激光器产生的488纳米(蓝色)谱线非常吻合,以及水银和氙弧放电灯的主线分别为436和467。此外,荧光素的量子产率非常高,并且已经收集了关于该染料在物理和化学性质方面的特征的大量信息。在消极方面,荧光素的荧光发射强度受环境因素(例如pH)的严重影响,并且相对宽的发射光谱通常与双标记和三标记实验中的其他荧光团重叠。
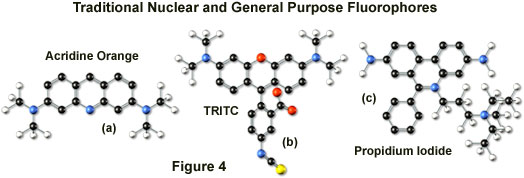
四甲基罗丹明(TMR)和异硫氰酸酯衍生物(TRITC; 图4(b))经常用于宽视场显微镜的多标记研究,因为它们通过来自汞弧放电灯的546纳米光谱线有效激发。荧光染料与荧光素具有显着的发射光谱重叠,可以通过氦氖激光器的543纳米线非常有效地激发,但不能通过氩离子和氪 - 氩激光器的514或568纳米线激发。当使用基于氪的激光系统时,丽森罗丹明在这种荧光染料类中是更好的选择,因为它在575纳米处具有最大吸收并且与荧光素的光谱分离。而且,罗丹明衍生物的荧光发射强度不依赖于与荧光素严格的环境条件。
几种在19世纪首次分离的吖啶染料可用作共聚焦显微镜中的荧光探针。最广泛使用的吖啶橙由基本吖啶核和位于三核环系统3和6位的二甲氨基取代基组成(如图4(a)所示)。在生理pH范围内,分子在杂环氮上质子化并主要作为溶液中的阳离子物质存在。吖啶橙通过连续碱基对之间的吖啶核嵌入而与DNA强烈结合,并显示出最大波长为530纳米的绿色荧光。探针还与RNA或单链DNA强烈结合,但当与这些大分子结合时具有更长波长的荧光最大值(约640纳米;红色)。在活细胞中,吖啶橙扩散穿过细胞膜(由于质子化的缔合常数)并在溶酶体和其他酸性囊泡中积累。与大多数吖啶和相关的多核氮杂环类似,吖啶橙具有相对宽的吸收光谱,这使得探针能够与来自氩离子激光器的若干波长一起使用。
在共聚焦显微镜中有用的另一种流行的传统探针是菲啶衍生物,碘化丙锭,首先作为抗锥虫病剂以及密切相关的溴化乙锭合成(图4(c))。碘化丙锭以类似于吖啶的方式与DNA结合(通过插入)以产生以617纳米为中心的橙红色荧光。带正电荷的荧光团对双链RNA也具有高亲和力。Propidium的吸收最大值为536纳米,可以通过氩离子(或氪 - 氩)激光器的488纳米或514纳米光谱线或绿色氦氖激光器的543纳米线激发。在多个细胞内结构的双重或三重标记期间,染料通常用作复染剂以突出细胞核。环境因素会影响丙锭的荧光光谱,特别是当染料与含有甘油的封固剂一起使用时。结构相似的溴化乙锭(也通过插入与DNA结合)产生更多的背景染色,因此不如丙锭有效。
DNA和染色质也可以用与双螺旋外部结合的染料染色。此类中最常用的荧光染料是4',6-二脒基-2-苯基吲哚(DAPI ;参见图1和图2)和双苯甲酰亚胺Hoechst这些探针是水溶性很强的,并且在双链DNA的小沟中外部与富含AT的碱基对簇结合,荧光强度显着增加。两种染料类别都可以通过351纳米光谱线的高功率氩离子激光器或354纳米线氦镉激光器来激发。与吖啶和菲啶类似,这些荧光探针作为用于多色荧光标记方案的核复染剂是流行的选择。当与相邻细胞结构中的绿色,黄色和红色探针耦合时,鲜艳的蓝色荧光发射产生显着的对比度。
Alexa Fluor染料
现代荧光团技术的巨大进步可以通过Molecular Probes(Alexa Fluor)引入的Alexa Fluor染料来说明是Molecular Probes的注册商标。与光谱相似的探针相比,这些磺化罗丹明衍生物表现出更高的量子产率以获得更强的荧光发射,并且具有几个额外的改进特征,包括增强的光稳定性,与普通激光线匹配的吸收光谱,pH不敏感性和高水溶性。实际上,Alexa Fluor染料对光漂白的抵抗力是如此显着,即使在经受高强度激光源照射时,荧光强度在没有抗褪色试剂的情况下在相对长的时间内保持稳定。该特征使水溶性Alexa Fluor探针易于用于活细胞和组织切片研究,以及传统的固定制剂。
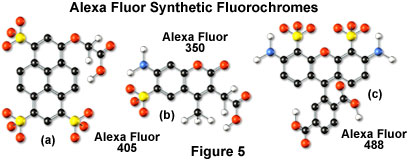
Alexa Fluor染料具有广泛的荧光激发和发射波长最大值,范围从紫外和深蓝色到近红外区域。各种染料的字母数字名称与探针所针对的特定激发激光或电弧放电灯光谱线相关联。例如,Alexa Fluor 488(如图5(c)所示)设计用于蓝色488纳米氩离子或氪离子激光器激发,而Alexa Fluor 568则与568纳米光谱线相匹配。氪 - 氩激光器。一些Alexa Fluor染料专门设计用于蓝色二极管激光器(405纳米;参见图5(a)中的Alexa Fluor 405化学结构),橙色/黄色氦 - 氖激光器(594纳米),或红色氦氖激光(633纳米)。其他Alexa Fluor染料用于在可见光(Alexa Fluor 546)或紫外线(Alexa Fluor 350,也适用于高功率氩离子激光器;图5(b))和固体中使用传统汞弧光放电灯进行激发。 - 状态红色二极管激光器(Alexa Fluor 680)。由于Alexa Fluor系列中有大量可用的激发和发射波长,因此通常可以使用这些染料进行多次标记实验。
Alexa Fluor染料可作为马来酰亚胺,琥珀酰亚胺酯和酰肼形式的活性中间体以及制备的细胞骨架探针(与鬼笔环肽,G-肌动蛋白和兔骨骼肌肌动蛋白缀合)和与凝集素,糊精,链霉抗生物素蛋白的缀合物商购获得。 ,抗生物素蛋白,生物胞素和各种二抗。在后一种形式中,Alexa Fluor荧光团为免疫细胞化学,神经科学和细胞生物学研究提供了广泛的工具。该探针家族还扩展到一系列具有重叠荧光发射最大值的染料,其目标是具有光谱成像和线性解混能力的复杂共聚焦显微镜检测系统。例如,Alexa Fluor 488,Alexa Fluor 500,和Alexa Fluor 514在视觉上相似,具有明亮的绿色荧光,但具有光谱上不同的发射轮廓。此外,三种荧光染料可以用氩离子激光器的488或514纳米光谱线激发,并且可以使用传统的荧光素滤光片组合轻松检测。在多光谱中(xy-λ;称为λ叠层的共焦成像实验,可以采用光学分离软件来区分相似的信号。Alexa Fluor 488,500和514的重叠发射光谱被分离成单独的通道,并且当三个荧光团在三标记研究中同时组合时,使用伪彩色技术进行区分。
花青染料
流行的花青染料家族Cy2,Cy3,Cy5,Cy7及其衍生物基于部分饱和的吲哚氮杂环核,其中两个芳族单元通过不同碳数的聚烯烃桥连接。这些探针显示出与许多传统染料相似的荧光激发和发射谱,例如荧光素和四甲基罗丹明,但具有增强的水溶性,光稳定性和更高的量子产率。大多数花青染料比其传统对应物更环保,使其荧光发射强度对pH和有机封固剂不太敏感。以类似于Alexa Fluors的方式,Cy系列合成染料的激发波长专门用于普通激光和电弧放电源,
由许多分销商销售的花青染料很容易作为活性染料或荧光团与各种二级抗体,糊精,链霉抗生物素蛋白和蛋白抗生物素蛋白偶联。花青染料通常具有比Alexa Fluor族成员更宽的吸收光谱区域,使得它们在用于共聚焦显微镜的激光激发源的选择方面更加通用。例如,使用来自氩离子激光器的547纳米光谱线,Cy2的荧光发射效率是Alexa Fluor 488的两倍。以类似的方式,514纳米氩离子激光线激发Cy3效率高于Alexa Fluor 546,一种光谱相似的探头。花青染料的发射谱在光谱宽度上与Alexa Fluor系列相当。
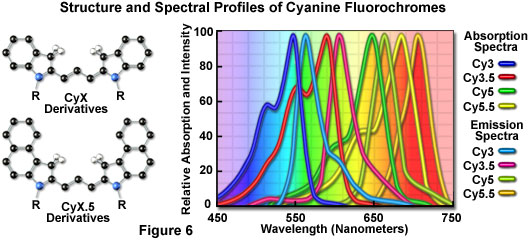
花青染料系列中包括长波长Cy5衍生物,它们在红色区域(650纳米)激发并以远红(680纳米)波长发射。Cy5荧光团通过氪 - 氩激光的647纳米谱线,红氦氖激光的633纳米线或红色二极管激光器的650纳米线非常有效地激发,提供激光的多功能性选择。因为从紫外和蓝光照射激发的传统荧光团中显着地去除了发射光谱分布,所以Cy5通常在三重标记实验中用作第三荧光团。然而,类似于在远红光谱区域中具有荧光发射的其他探针,Cy5对人眼不可见,只能通过电子方式检测(使用专门的CCD相机系统或光电倍增管)。因此,探针很少用于传统的宽视场荧光实验。
荧光环境探测器
用于探测活细胞内部环境的荧光团已被许多研究人员广泛研究,并且已开发出数百种用于监测碱金属和碱土金属,重金属(生物化学用作酶辅助因子)的局部浓度等效应,无机离子,硫醇和硫化物,亚硝酸盐,以及pH,溶剂极性和膜电位。最初,该领域的实验集中在荧光团结合钙离子以显示细胞内通量密度时所显示的吸收和发射光谱的波长和/或强度的变化。这些探针以高度特异性结合靶离子以产生测量的响应,并且通常被称为光谱敏感指示剂。通过应用光学比率信号分析来确定离子浓度变化以监测离子与其宿主之间的缔合平衡。源自该技术的浓度值很大程度上不依赖于仪器变化和由于光漂白,负载参数和细胞保留引起的探针浓度波动。在过去的几年中,已经开发了许多新的试剂,它们结合特定的离子或以可测量的特征响应其他环境条件。
钙是一种代谢重要的离子,在细胞对许多形式的外部刺激的反应中起着至关重要的作用。因为当细胞经历响应时通常涉及钙离子浓度的瞬时波动,所以必须设计荧光团以不仅测量隔离区室内的局部浓度,而且还应当当通量密度波在整个细胞质中进展时产生定量变化。设计用于测量钙水平的许多合成分子基于非荧光螯合剂EGTA和BAPTA已经使用多年来在缓冲溶液中螯合钙离子。两种最常见的钙探针是比率指示剂fura-2和indo-1,但这些荧光团在共聚焦显微镜中不是特别有用。染料被紫外光激发,并且当结合钙时,表现出激发或发射光谱的变化,同时形成等吸光点。然而,与紫外成像相关的光学像差,有限的样品穿透深度和紫外激光的费用限制了这些探针在共聚焦显微镜中的实用性。
遗憾的是,钙离子通量在可见光范围内响应的荧光团不是比率指示剂,并且在结合时不表现出波长漂移(典型的是fura-2和indo-1),尽管它们确实经历荧光强度的增加或减少。 最好的例子是fluo-3,一种复杂的x吨衍生物,当被氩离子或氪 - 氩激光器的488纳米谱线激发时,其在525纳米(绿色)下的荧光发射显着增加。因为不存在等吸光点以确保没有浓度波动,所以不可能确定光谱变化是由于复合物形成还是由于荧光-3和类似荧光团的浓度变化。
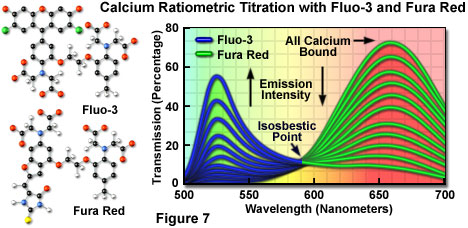
为了克服与使用缺乏波长漂移的可见光探针(和等吸光点)相关的问题,这些染料中的一些通常组合用于共聚焦显微镜中的钙测量。Fura red,一种多核咪唑和苯并呋喃杂环,当结合钙时,在650纳米处显示荧光减少。当在488纳米处激发fluo-3和fura red的混合物并且在两个探针的发射最大值(分别为525和650纳米)下测量荧光时,可以获得对钙离子通量的比率响应。因为fluo-3的发射强度单调增加而fura-3的发射强度同时下降,当染料浓度在被研究的局部区域内恒定时获得等吸光点(如图7所示)。将这些探针一起使用的另一个好处是能够使用标准FITC / Texas红色干涉滤光片组合测量荧光强度波动。
使用类似的荧光团以类似的方式定量测量除钙之外的离子,例如镁,钠,钾和锌。最受欢迎的镁探针之一,mag-fura-2(结构上与fura红相似)也在紫外线范围内被激发,并且在共聚焦显微镜中出现与fura-2和indo-1相同的问题。在可见光区域中激发的荧光团变得可用于分析在细胞基质中以不同浓度存在的许多单价和二价阳离子。还开发了几种合成有机探针用于监测简单和复杂阴离子的浓度。
用于细胞内pH的重要荧光监测器包括称为HPTS或吡喃的芘衍生物,荧光素衍生物,BCECF和另一种被称为羧基SNARF-1的取代的x吨。因为许多常见的荧光团对周围介质中的pH敏感,所以通常归因于生物相互作用的荧光强度的变化实际上可能由于质子化而发生。在生理pH范围(pH6.8至7.4)中,上述探针可用于双波长比率测量,并且仅在染料负载参数方面不同。钙离子浓度和pH的同时测量通常可以通过将pH指示剂(例如SNARF-1)与钙离子指示剂(例如,fura-2)组合来实现。已经开发了其他探针用于亚细胞区室中的pH测量,例如溶酶体,如下所述。
Organelle探测器
靶向特定细胞内细胞器的荧光团,例如线粒体,溶酶体,高尔基体和内质网,可用于使用共聚焦显微镜监测活细胞中的多种生物过程。通常,细胞器探针由附着于靶特异性部分的荧光染料核组成,其有助于通过共价,静电,疏水或类似类型的键定位荧光团。设计用于选择细胞器的许多荧光探针能够渗透或隔离细胞膜(因此,可用于活细胞),而其他荧光探针必须使用具有传统免疫细胞化学技术的单克隆抗体进行安装。在活细胞中,细胞器探针可用于研究运输,呼吸,有丝分裂,细胞凋亡,蛋白质降解,酸性区室和膜现象。细胞不透性荧光团应用包括核功能,细胞骨架结构,细胞器检测和膜完整性探针。在许多情况下,已经用渗透探针标记的活细胞随后可以在多色标记实验中固定并用另外的荧光团复染。
线粒体探针是用于研究细胞呼吸的最有用的荧光团之一,并且通常在多标记研究中与其他染料一起使用。当细胞被固定时,传统探针罗丹明123和四甲基胺迅速消失,并且已经被Molecular Probes开发的更新,更特异的荧光团取代。这些包括流行的MitoTracker(参见图8(b))和MitoFluor系列结构多样的x吨,苯并恶唑,吲哚和苯并咪唑杂环,它们具有各种激发和发射光谱分布。对于该系列中的每种探针,作用机制各不相同,范围从共价附着到呼吸线粒体膜内的氧化。
MitoTracker染料在甲醛中固定细胞后保留得很好,并且通常可以承受亲脂性透化剂。相比之下,MitoFluor探针专为主动呼吸细胞而设计,不适用于固定和复染程序。另一种流行的线粒体探针,名为JC-1,可用作膜电位的指示剂和固定细胞的多重染色实验。该羰花青染料在低浓度下呈现绿色荧光,但在活性线粒体内可发生分子内缔合,从而产生向更长(红色)波长的发射转变。发射波长的变化可用于确定活细胞中活性线粒体与非活性线粒体的比例。
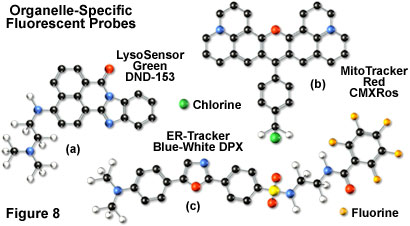
通常,能够通过膜的弱碱性胺是研究溶酶体中生物合成和发病机理的理想候选物。传统的溶酶体探针包括非特异性吩嗪和吖啶衍生物中性红和吖啶橙,它们在质子化后积聚在酸性囊泡中。荧光标记的乳胶珠和大分子(例如葡聚糖)也可以通过内吞作用在溶酶体中积累用于各种实验。然而,用共聚焦显微镜研究溶酶体特性的最有用的工具是Molecular Probes开发的LysoTracker和LysoSensor染料。这些结构上不同的试剂含有杂环和脂肪族氮部分,其调节染料向活细胞溶酶体的转运,用于短期和长期研究。LysoTracker探针具有多种激发和发射波长,对酸性细胞器具有高选择性,能够以纳摩尔浓度标记细胞。在固定和透化细胞后,几种染料保留得很好。相反,LysoSensor荧光团(图8(a))设计用于研究活细胞中溶酶体功能的动态方面。质子化后LysoSensor系列的荧光强度显着增加,使这些染料可用作pH指示剂。
蛋白质和脂质在高尔基体中分选和加工,其通常用神经酰胺和鞘脂的荧光衍生物染色。这些试剂是高度亲脂性的,因此可用作研究活细胞中脂质转运和代谢的标志物。用于高尔基体的几种最有用的荧光团含有复杂的杂环BODIPY由Molecular Probes开发的细胞核。当与鞘脂偶联时,BODIPY荧光团具有高选择性,并且对光漂白具有耐受性,远远优于许多其他染料。此外,发射光谱取决于浓度(在较高浓度下从绿色变为红色),使得探针可用于定位和鉴定积聚大量脂质的细胞内结构。在活细胞实验期间,荧光脂质探针可以经历代谢成可能与其他亚细胞特征结合的衍生物,这一因素通常使实验数据的分析复杂化。
用于内质网荧光分析的最流行的传统探针分别是羰花青和x吨染料,DiOC(6)和几种罗丹明衍生物。然而,这些染料必须谨慎使用,因为它们也可以在线粒体,高尔基体和其他细胞内亲脂性区域积聚。已经开发了更新的,更光稳定的探针,用于由几个制造商选择性染色内质网。特别地,Molecular Probes生产的Dapoxyl家族的恶唑成员(参见图8(c))是用于在活细胞中单独或与其他染料组合选择性标记内质网的优异试剂。这些探针在用甲醛固定后保留,但可能会用透化洗涤剂丢失。另一个有用的探针是Brefeldin A,一种立体化学复杂的真菌代谢物,可作为内质网外蛋白质运输的抑制剂。最后,类似于其他细胞器,已经开发了单克隆抗体,其靶向固定细胞中的内质网用于免疫细胞化学研究。
量子点
被称为量子点的纳米级纯化半导体晶体正在成为传统宽视场和激光扫描共聚焦荧光显微镜中用于活细胞和固定细胞的潜在有用的荧光标记剂。最近引入的技术使得纯化的微小半导体晶体能够涂覆有亲水性聚合物壳并与抗体或其他生物活性肽和碳水化合物缀合,以用于许多经典的免疫细胞化学方案。与有机染料和荧光蛋白相比,这些探针具有显着的优势,包括长期光稳定性,高荧光强度水平,以及针对所有发射谱的单波长激发的多种颜色。
量子点以类似于众所周知的半导体发光二极管的方式产生照明,但是通过吸收光子而不是电刺激来激活。吸收的光子产生电子 - 空穴对,其快速重新组合,同时发射具有较低能量的光子。迄今为止发现的用于产生生物量子点的最有用的半导体是硒化镉(CdSe),其中发射的光子的能量是纳米晶体颗粒的物理尺寸的函数。因此,尺寸仅相差十分之一纳米的量子点发射不同波长的光,较小尺寸发射较短波长,反之亦然。
与显示高度定义的光谱分布的典型有机荧光团或荧光蛋白不同,量子点具有随着波长减小而稳定增加的吸收光谱。而且相反,荧光发射强度被限制在对称峰值,其最大波长取决于点尺寸,但与激发波长无关。结果,无论量子点是在300,400,500或600纳米处被激发,都观察到相同的发射分布,但是在较短的激发波长下荧光强度显着增加。例如,当半导体在400对600纳米处激发时,在橙色区域(605纳米)中发射的典型量子点共轭的消光系数大约高5倍。典型的量子点共轭物的半峰全宽为约30纳米,并且光谱分布不向较长波长(具有较高强度的“尾部”)偏斜,大多数有机荧光染料的情况也是如此。窄发射分布使得能够以最小水平的渗透同时观察到几个量子点共轭。
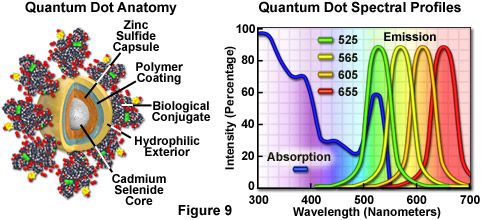
对于生物学应用,相对均匀的硒化镉晶体群被周围的由硫化锌组成的半导体壳覆盖,以改善光学性质。接下来,芯材料涂覆有聚合物膜和其他配体,以降低疏水性并提高共轭大分子的附着效率。最终产品是一种生物活性颗粒,其大小范围为10至15纳米,位于大蛋白质附近。量子点缀合物在常见的生物缓冲液中作为胶体悬浮液溶解,并且可以结合到现有的标记方案中代替经典的染色试剂(例如有机荧光染料标记的第二抗体)。
在共聚焦显微镜中,通过常见激光系统产生的大多数光谱线,包括氩离子,氦 - 镉,氪 - 氩和绿氦 - 氖,可以以不同程度的效率激发量子点。在紫外和紫色区域激发量子点特别有效的是新的蓝色二极管和二极管泵浦固态激光器,它们在442纳米及以下具有突出的光谱线。405纳米蓝色二极管激光器是一种经济的激发光源,由于其在该波长下具有高消光系数,因此非常适用于量子点。在共聚焦显微镜中使用这些荧光团的另一个优点是能够在单一激发波长下刺激同一样品中的多个量子点尺寸(和光谱颜色),
当收集光学切片时,量子点共轭物的特殊光稳定性在共聚焦显微镜中具有很大的优势。与有机荧光团的情况不同,远离焦平面的标记结构在样本的重复光栅扫描期间不会遭受过度的光漂白,并产生更准确的三维体积模型。在宽视场荧光显微镜中,量子点共轭可用于常规染料优化的滤光器组合,这是许多显微镜上的标准设备。通过用短通滤波器代替伴随大多数滤波器组的带通滤波器,可以进一步增强激励,从而优化可用于激发量子点的灯能量。
荧光蛋白
在过去几年中,天然存在的荧光蛋白和突变衍生物的发现和发展已经迅速发展到研究生物体内广谱细胞内过程的中心阶段。这些生物探针为科学家提供了在稳态和动力学实验中以高空间和时间分辨率可视化,监测和跟踪单个分子的能力。多种海洋生物已成为超过25种荧光蛋白及其类似物的来源,这使得研究人员能够使用平衡的非侵入性生物探针调色板进行单,双和多光谱荧光分析。与上述传统有机和新半导体探针相比,荧光蛋白的优点之一是它们对更广泛的生物事件和信号的响应。这些生物大分子具有在亚细胞区室中特异性靶向荧光探针的能力,极低或不存在的光动力学毒性以及与组织和完整生物的广泛兼容性,为活细胞成像提供了令人兴奋的新前沿。
该系列的第一个成员,绿色荧光蛋白(GFP),是从北大西洋水母,维多利亚水母(Aequorea victoria)中分离出来的。并且发现在没有额外的底物或辅酶的帮助下表现出高度的荧光。在天然绿色荧光蛋白中,荧光部分是丝氨酸,酪氨酸和甘氨酸的三肽衍生物,其需要分子氧用于活化,但不需要额外的辅因子或酶。随后的研究表明,GFP基因可以在其他生物体中表达,包括哺乳动物,以产生不显示不良生物学效应的全功能类似物。实际上,使用重组互补DNA克隆技术,荧光蛋白可以与活细胞中的几乎任何蛋白融合,并且所得到的融合蛋白基因产物在细胞系中表达,适合于标准组织培养方法。
用绿色荧光蛋白进行的诱变实验产生了大量具有改善的折叠和表达特征的变体,其消除了野生型二聚体伪影并微调了吸收和荧光性质。最早的变体之一,称为增强型绿色荧光蛋白(EGFP),含有密码子取代(通常称为S65T)突变)减轻温度敏感性并提高哺乳动物细胞中GFP表达的效率。与EGFP融合的蛋白质可以在低光强度下长时间观察到光漂白最少。增强型绿色荧光蛋白融合产物被共聚焦显微镜中氩和氪 - 氩离子激光器的488纳米光谱线最佳激发。这提供了优异的生物探针和仪器组合,用于检查细胞内蛋白质途径以及细胞器和细胞骨架的结构动力学。
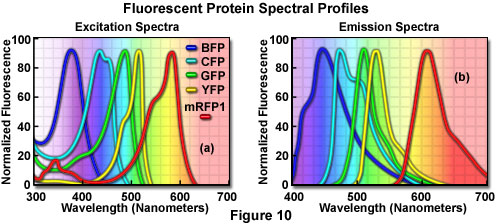
其他突变研究揭示了GFP变体,这些变异在整个可见光谱区域具有多种吸收和发射特征,这使得研究人员能够开发出探针组合,用于同时观察单个生物体中两种或多种不同的荧光蛋白(参见光谱图谱)在图10中)。早期研究产生了来自简单氨基酸取代的蓝色荧光蛋白(BFP)和青色荧光蛋白(CFP)突变体,其将野生型GFP的吸收和发射光谱曲线转移到较低波长区域。与GFP结合使用,这些衍生物可用于共振能量转移(FRET)实验和其他依赖多色荧光成像的研究。使用高功率氩激光器的354纳米线可以有效激发蓝色荧光蛋白,而更多有用的青色衍生物被许多紫色和蓝色激光线激发,包括405纳米蓝色二极管,442-纳米氦镉谱线,以及标准氩离子激光器的457纳米线。
另一种流行的荧光蛋白衍生物黄色荧光蛋白(YFP)是在GFP晶体结构分析的基础上设计的,用于红移吸收和发射光谱。黄色荧光蛋白被氩离子激光器的514纳米光谱线最佳激发,并且比增强的绿色荧光蛋白提供更强的发射,但是对低pH和高卤素离子浓度更敏感。增强的黄色荧光蛋白衍生物(EYFP)对于514氩离子激光线是有用的,但也可以通过来自氩和氪 - 氩激光器的488纳米线以相对高的效率激发。这两种荧光蛋白衍生物已经广泛应用于与CFP组合的蛋白质 - 蛋白质FRET研究,并且已经证明在涉及多蛋白运输的研究中是有用的。
试图将维多利亚水母(Aequorea victoria)荧光蛋白的吸收和发射光谱转移到光谱的橙色和红色区域的波长,但收效甚微。然而,来自其他海洋物种的荧光蛋白使研究人员能够将可用的光谱区域扩展到红色波长范围内。最初从海葵Discosoma striata中分离的DsRed荧光蛋白及其衍生物是目前在575至650纳米区域中最常用的荧光分析类似物。另一种蛋白质,HcRed从Heteractis皱紫色海葵也是研究可见光谱较长波长的有希望的候选者。新开发的光活化荧光蛋白,包括可光活化的绿色荧光蛋白(PA-GFP),Kaede和点燃荧光蛋白1(KFP1),当紫外激光照射刺激时,荧光强度显着优于GFP(高达数千倍) 。这些探针应该证明在涉及特定靶区域的选择性照射的荧光共聚焦研究以及随后的融合蛋白的扩散迁移率和区室驻留时间的动力学分析中是有用的。
淬火和光漂白
淬火和光漂白的后果在几乎所有形式的荧光显微镜中都受到影响,并导致有效降低发射水平。在设计和执行荧光研究时,这些伪影应该是首要考虑因素。这两种现象的区别在于淬火通常是可逆的,而光漂白则不然。猝灭源于各种竞争过程,这些过程诱导激发态电子向基态的非辐射弛豫(没有光子发射),其可以是分子内或分子间性质的。由于非辐射跃迁途径与荧光弛豫竞争,它们通常会显着降低或在某些情况下完全消除发射。
通过激发态荧光团与另一种(非荧光)分子在溶液中的碰撞观察到猝灭的常见实例,导致荧光团失活并返回基态。在大多数情况下,在碰撞淬火过程中,这两种分子都没有发生化学变化。各种各样的简单元素和化合物表现为碰撞猝灭剂,包括氧,卤素,胺和许多缺电子的有机分子。碰撞猝灭可以揭示局部猝灭剂分子或部分的存在,其通过扩散或构象变化,可以在激发态寿命期间与荧光团碰撞。碰撞猝灭的机制包括电子转移,自旋轨道耦合和系统间交叉到激发三重态。通常与碰撞淬火互换使用的其他术语是内部转换和动态淬火。
第二种淬火机制,称为静态或复杂猝灭,来自猝灭剂和荧光团之间形成的非荧光复合物,其通过减少活性可激发分子的群体来限制吸收。当荧光物质与淬灭剂分子处于基态时形成可逆复合物并且不依赖于扩散或分子碰撞时,会发生这种效应。在静态猝灭中,荧光发射减少而不改变激发态寿命。处于激发态的荧光团也可以在与受体分子非常接近时通过偶极共振能量转移机制猝灭,受体分子可以非辐射地转移激发态能量。在一些情况下,猝灭可以通过非分子机制发生,例如吸收物质(包括发色团本身)对入射光的衰减。
与淬火,光漂白(也称为褪色)相反当荧光团由于光子诱导的化学损伤和共价修饰而永久失去发荧光的能力时,会发生这种情况。在从激发的单线态转变为激发的三线态后,荧光团可以与另一分子相互作用以产生不可逆的共价修饰。三重态相对于单重态具有相对长的寿命,因此允许激发的分子在更长的时间内与环境中的组分发生化学反应。在光漂白之前特定荧光团发生的平均激发和发射循环数取决于分子结构和局部环境。一些荧光团在仅发射少量光子后迅速漂白,
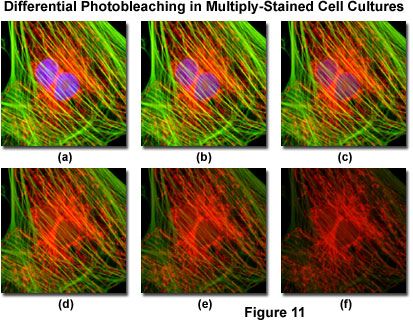
图11中显示了在不同时间点捕获的一系列数字图像中观察到的光漂白(褪色)的典型实例,用于印度Muntjac鹿皮成纤维细胞的多染色培养。细胞核用DAPI(蓝色荧光)染色,而线粒体和肌动蛋白细胞骨架分别用MitoTracker Red(红色荧光)和Alexa Fluor鬼笔环肽衍生物(Alexa Fluor 488;绿色荧光)染色。使用荧光滤光器组合以两分钟的间隔拍摄时间点,其中带宽被调谐以同时激发三个荧光团,同时还记录组合的发射信号。请注意,图11(a)中所有三种荧光团都具有相对较高的强度,但DAPI(蓝色)强度在两分钟时开始迅速下降,几乎在六分钟后完全消失。线粒体和肌动蛋白染色剂对光漂白具有更强的抵抗力,但两者的强度在定时序列(10分钟)的过程中下降。
一类重要的光漂白事件是光动力学的,意味着它们涉及荧光团与光和氧的组合的相互作用。荧光团和分子氧之间的反应永久地破坏荧光并产生自由基单线态氧物质,其可以化学修饰活细胞中的其他分子。由光动力事件引起的光漂白量是分子氧浓度和荧光团,氧分子和其他细胞组分之间的近端距离的函数。通过限制荧光团暴露于照射的时间或通过降低激发能量可以减少光漂白。然而,这些技术也减少了可测量的荧光信号。在许多情况下,荧光团或细胞悬浮液的溶液可以脱氧,但这对于活细胞和组织是不可行的。
在某些情况下,还可以利用光漂白效果来获得否则将不可用的特定信息。例如,在光漂白(FRAP)实验后的荧光恢复中,目标区域内的荧光团被有意地用过量的照射漂白。随着新的荧光团分子扩散到样品的漂白区域(恢复),监测荧光发射强度以确定目标荧光团的横向扩散速率。以这种方式,荧光标记分子的平移迁移率可以在单个细胞或活组织切片的非常小(2至5微米)的区域内确定。
结论
尽管在共聚焦显微镜中有利的荧光团子集正在快速增长,但是许多在宽视场应用中已经使用多年的传统探针在受固定波长激光光谱线约束时仍然没有多大用处。围绕使用在紫外区激发的荧光团的许多限制将通过引入先进的物镜来消除,这些物镜旨在减少像差,并逐渐引入低成本,高功率的二极管激光系统,这些激光系统具有这些较短波长的光谱线。405纳米蓝色二极管激光器是更昂贵的离子和Noble气体紫外激光器的一种相当便宜的替代品,并且很快就可用于大多数共聚焦显微镜系统。在黄色和橙色区域具有光谱线的氦 - 氖激光器已经使一些荧光团有用,这些荧光团以前仅限于宽视场应用。此外,正在引入新的二极管泵浦固态激光器,其发射波长在紫外,紫色和蓝色区域。
荧光团设计,双激光扫描,多光谱成像和旋转磁盘应用的持续进步在未来几年也将是重要的。在多色研究中由许多合成探针和荧光蛋白发生的光谱重叠导致的发射交叉的持续问题,从λ堆的光谱分析和反卷积中获益很大。结合起来,这些进步将极大地改善从活细胞成像中的复杂荧光实验获得的数据的收集和分析。