

- 您好,欢迎您访问成贯仪器官方网站!


共聚焦显微镜与常规的宽视野光学显微镜相比具有许多优势,包括控制景深的能力,消除或减少远离焦平面的背景信息(导致图像质量下降)以及收集连续光学切片的能力从厚厚的标本。共聚焦方法的基本关键是使用空间滤波技术,以消除厚度超过焦平面的样品中散焦的光线或眩光。近年来,共聚焦显微镜的普及发生了巨大的爆炸,部分原因是由于相对容易,可以从为常规荧光显微镜准备的标本中获得极高质量的图像,并且在细胞生物学中的应用越来越多依靠固定和活细胞和组织的成像。实际上,共聚焦技术已被证明是光学显微镜领域最重要的进步之一。
在常规的宽视场光学落射荧光显微镜中,标本发出的二次荧光经常通过激发体积发生,并且掩盖了物镜焦平面中的特征的分辨率。较厚的标本(大于2um)使问题更加复杂,标本通常会显示出很高的荧光发射率,以至于大部分细节都丢失了。共聚焦显微镜只能在轴向(z;沿光轴)和横向(x和y)上提供少量改进;光学分辨率,但能够从结果图像中排除从焦平面移出的区域中的二次荧光。即使使用共聚焦显微镜比常规的宽场技术在某种程度上提高了分辨率,但其分辨率仍远低于透射电子显微镜。在这方面,共聚焦显微镜可以被认为是这两种经典方法之间的桥梁。
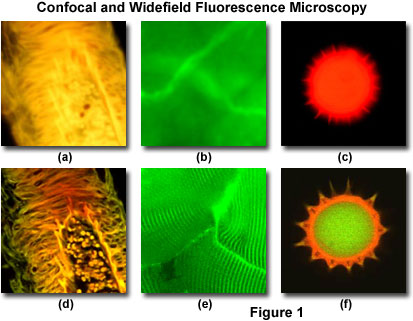
图1展示了一系列图像,这些图像比较了传统的宽视场和激光扫描共聚焦荧光显微镜中的选定视场。在宽视场荧光中,荧光染色的人髓质的厚部分显示出焦平面上方和下方的荧光结构产生的大量眩光(图1(a))。当用激光扫描共聚焦显微镜成像时(图1(d)),髓质较厚的部分显示出相当程度的结构细节。同样,用荧光素染色的全兔肌肉纤维的宽视野荧光成像产生的模糊图像(图1(b))缺乏详细信息,而同一标本场(图1(e))则在共聚焦显微镜下显示出高度条纹状的形貌。向日葵花粉粒中的自发荧光产生基本外部形态的模糊轮廓(图1(c)),但未显示内部结构。相反,通过共焦技术获得的相同晶粒的薄光学截面(图1(f))显示出粒子核与周围包膜之间的巨大差异。
历史的角度
共聚焦显微镜的基本概念最初是由Marvin Minsky在1950年代中期(1957年获得专利)发明的,当时他是哈佛大学的博士后。明斯基想对未染色的脑组织制剂中的神经网络进行成像,并且受到了对生物事件在活体系统中发生成像的渴望。明斯基的发明在很大程度上未被注意到,这很可能是由于缺乏成像所需的强光源以及处理大量数据所需的计算机功率。在Minsky的工作之后,M。David Egger和Mojmir Petran于1960年代后期制造了多光束共聚焦显微镜,该显微镜利用旋转的(Nipkow)盘检查未染色的脑切片和神经节细胞。继续这个竞技场,
幸运的是,在明斯基的专利到期后不久,几位研究人员将实用的激光扫描共聚焦显微镜设计转化为工作仪器。荷兰物理学家G. Fred Brakenhoff于1979年开发了一种扫描共聚焦显微镜,而与此同时,Colin Sheppard则以成像理论为该技术做出了贡献。托尼·威尔逊(Tony Wilson),布拉德·阿莫斯(Brad Amos)和约翰·怀特(John White)提出了这个概念,后来(在1980年代后期)展示了共聚焦成像在荧光生物标本检查中的实用性。1987年出现了第一批商用仪器。在1990年代,光学和电子学的进步提供了更稳定,功能更强的激光器,高效扫描镜单元,高通量光纤,更好的薄膜电介质涂层,以及噪声特性降低的检测器。另外,与激光激发线更仔细匹配的荧光染料开始合成。伴随着1990年代后期新兴的计算机处理速度,增强的显示器和大容量存储技术的迅速发展,激光扫描共聚焦显微镜可以瞄准的应用程序数量实际上将出现爆炸式增长。
现代共聚焦显微镜可被视为完全集成的电子系统,其中光学显微镜在由一个或多个电子探测器,计算机(用于图像显示,处理,输出和存储)和多个激光系统组成的配置中起着核心作用。结合波长选择设备和光束扫描组件。在大多数情况下,各个组件之间的集成是如此彻底,以至于整个共聚焦显微镜通常统称为能够产生电子图像的数字或视频成像系统。这些显微镜现在被用于对分子,细胞和活组织的常规研究,而这在几年前是不可能的。
共聚焦显微镜原理
落射荧光激光扫描显微镜的共聚焦原理如图2所示。激光系统(激发源)发出的相干光穿过位于共轭平面(共聚焦)中的针孔,样品上有扫描点第二针孔位于检测器(光电倍增管)的前面。当激光被双色镜反射并在限定的焦平面上扫描整个样品时,从样品上的点(在同一焦平面上)发出的二次荧光会通过双色镜返回并聚焦为共焦点。检测器针孔孔径。

在物镜焦平面的上方和下方的点处发生的大量荧光发射与针孔不共焦(称为焦点外光线)并在光圈平面上形成扩展的艾里斑。因为只有一小部分的散焦荧光发射是通过针孔孔径传递的,所以大多数这种外部光都不会被光电倍增管检测到,并且不会对所得图像有所贡献。双色镜,势垒滤镜和激发滤镜执行的功能与宽视野落射荧光显微镜中的相同组件相同。在共焦显微镜中重新聚焦物镜将样品上的激发点和发射点移动到一个新平面,该平面与光源和检测器的针孔一致。
在传统的宽视野落射荧光显微镜中,整个标本都受到不相干的水银或氙弧放电灯的强烈照射,所产生的二次荧光发射图像可以直接在目镜中观察或投射到电子设备的表面上阵列探测器或传统胶片平面。与这个简单的概念相反,共聚焦显微镜中图像形成的机理根本不同。如上所述,共焦荧光显微镜包括多个激光激发源,一个带有光学和电子组件的扫描头,电子探测器(通常是光电倍增管)和一台用于采集,处理,分析和显示图像的计算机。
扫描头位于共聚焦系统的中心,负责对激发扫描进行光栅化,并从标本中收集组装最终图像所需的光子信号。典型的扫描头包含来自外部激光源,荧光滤光片组和双色镜,基于检流计的光栅扫描镜系统,用于生成共焦图像的可变针孔孔径以及针对不同荧光波长调整的光电倍增管检测器的输入。图3显示了典型商用单元的扫描头组件的总体布置。
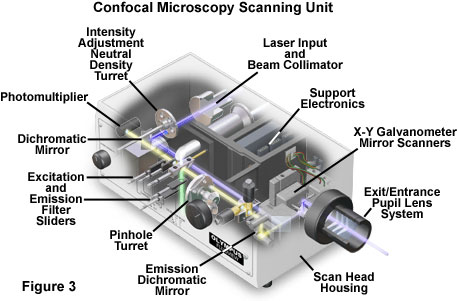
在落射照明共聚焦显微镜中,激光源和光电倍增管检测器都通过物镜与标本分离,该物镜用作校正良好的聚光镜和物镜组合。内部荧光滤光片组件(例如激发滤光片和势垒滤光片以及双色镜)和中性密度滤光片包含在扫描单元内(请参见图3)。干涉滤光片和中性密度滤光片装在旋转的转塔或滑块中,操作员可以将其插入光路。激发激光束通过光纤耦合器连接到扫描单元,然后通过扩束器将细激光束腕部完全填充物镜后孔(共聚焦显微镜的一项关键要求),并将其连接到扫描仪上。
扫描单元最重要的组件之一是针孔,该孔在位于光电倍增管正前方的共轭像平面上充当空间滤波器。通常在旋转转塔上装有几个直径不同的孔,使操作员可以调节针孔尺寸(和光学部分的厚度)。物镜收集的二次荧光被去扫描由形成光栅图案的振镜反射,然后通过屏障过滤器再到达针孔。该孔用于排除来自焦平面上方和下方的失焦特征的荧光信号,这些荧光信号作为直径大于形成图像的艾里斑的方式投射到孔上。这些超大尺寸的光盘散布在一个较大的区域上,因此只有一小部分来自远离焦点的平面的光会通过光圈。针孔也可以消除大部分通过光学系统的杂散光。共焦显微镜的一个重要特征是将孔径受限点扫描耦合到共轭像面上的针孔空间滤波器。
当对比宽视野和共聚焦显微镜之间的相似点和不同点时,比较每种技术使用的样品照明的特征和几何形状通常很有用。传统的宽视场落射荧光显微镜物镜将大范围的照明光聚焦在大量标本上,并均匀且同时进行照明(如图4(a)所示)。物镜(取决于数值孔径)将大部分返回显微镜的荧光发射物收集并投射到目镜或检测器中。结果是由于发出的背景光和来自焦平面上方和下方区域的自发荧光而产生了大量信号,这严重降低了分辨率和图像对比度。

共聚焦显微镜中的激光照明源首先被扩展以填充物镜后孔径,然后由透镜系统聚焦到焦平面上的一个非常小的点(图4(b))。照明点的大小范围为直径大约0.25到0.8um(取决于物镜数值孔径),并且在最亮的强度下的深度为0.5到1.5um。共焦点的大小由显微镜设计,入射激光的波长,物镜特性,扫描单元设置和样本确定。图4所示是在相同的数值孔径下,宽视场(图4(a))和点扫描共焦(图4(b))显微镜的典型照明锥之间的比较。宽视野显微镜照亮了整个样品区域的整个深度
在激光扫描共聚焦显微镜中,通过以光栅图案在特定区域上扫描聚焦光束来生成扩展样品的图像,该光栅图案由两个由振镜马达驱动的高速振荡镜控制。其中一个反射镜沿x横轴从左向右移动光束,另一个反射镜沿y方向平移光束。沿x轴进行每次扫描后,光束会快速传输回起点并沿y轴移动,从而在称为反激的过程中开始新的扫描。在反激操作期间,不会收集图像信息。以这种方式,通过来自扫描单元的激光照射来激发样品在单个焦平面上的感兴趣区域。
当每条扫描线在侧向焦平面上穿过样品时,物镜收集荧光发射,并通过共焦光学系统传回。扫描镜的速度相对于光速非常慢,因此二次发射沿着光轴沿着与原始激发光束相同的光路。通过检流计反射镜系统返回的荧光称为去扫描。离开扫描镜后,荧光发射直接穿过双色镜,并聚焦在检测器针孔上。与通过样品的激发光的光栅扫描图案不同,荧光发射在针孔处保持稳定的位置,但是随着照射点穿过样品而产生强度变化,其强度随时间而波动。
通过针孔的荧光发射被光电倍增管转换成具有连续变化的电压(与强度相对应)的模拟电信号。扫描单元或随附的电子柜中装有一个模数(A / D)转换器,定期对模拟信号进行采样并转换为像素。图像信息临时存储在计算机中的图像帧缓冲卡中,并显示在监视器上。重要的是要注意,标本的共聚焦图像是通过光电倍增管和随附的电子设备从发射光子信号逐点重建的,但从来没有作为可通过显微镜目镜观察到的真实图像而存在。
激光扫描共聚焦显微镜配置
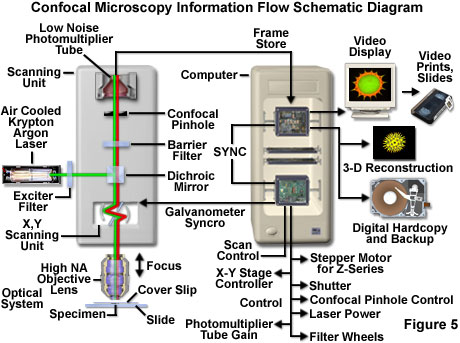
由于物镜设计的工程限制,大多数标本的静态特性以及分辨率取决于光的波长这一事实,显微镜的基本光学系统特性几十年来一直保持根本不变。但是,用来与生物样本形成对比的荧光探针,以及与光学显微镜技术相关的其他技术,已得到显着改善。共聚焦方法的爆炸性增长和发展是光学显微镜复兴的直接结果,现代光学和电子技术的发展在很大程度上推动了光学显微镜的复兴。其中有稳定的多波长激光系统,可以更好地覆盖紫外线,可见光和近红外光谱区域,改进的干涉滤光片(包括双色镜,屏障和激发滤光片),灵敏的低噪声宽带检测器以及功能更强大的计算机。后者现在可用相对低成本的存储器阵列,图像分析软件包,高分辨率视频显示器和高质量的数字图像打印机提供。通过现代共聚焦显微镜的信息流如图5所示。
尽管这些技术中有许多是针对各种特定物镜应用独立开发的,但它们已逐渐被纳入主流的商用共聚焦显微镜系统中。在当前的显微镜系统中,设计的分类是基于用于扫描标本的技术。扫描既可以通过在x,y和z方向上平移载物台,又可以将激光照明点固定在一个固定位置来完成,也可以对光束本身进行光栅扫描。由于载物台的三维平移很麻烦并且容易振动,因此大多数现代仪器都采用某种类型的束扫描机制。
在现代共聚焦显微镜中,已经开发出两种根本不同的光束扫描技术。单光束扫描是大多数商用激光扫描显微镜中较常用的一种方法,它使用一对计算机控制的检流计镜以大约每秒一帧的速度以光栅模式扫描样品。使用声光设备或振荡镜可以实现更快的扫描速度(接近视频速度)。相比之下,多光束扫描共聚焦显微镜配备了旋转的Nipkow包含针孔和微透镜阵列的磁盘。这些仪器通常使用弧光放电灯代替激光照明,以减少样品损坏并在实时图像采集过程中增强对低荧光水平的检测。多光束显微镜的另一个重要特征是它们能够利用阵列检测器(例如电荷耦合器件(CCD)摄像系统)轻松捕获图像。
所有激光扫描共聚焦显微镜的设计都围绕传统的直立或倒置显微镜。但是,代替标准的钨卤素灯或汞弧光放电灯,而是使用一个或多个激光系统作为光源来激发样品中的荧光团。图像信息通过专用检测器(如光电倍增管或雪崩光电二极管)逐点收集,然后数字化以供主机处理,该主机还控制扫描镜和/或其他设备以促进图像的收集和显示。在获取了一系列图像(通常是串行光学部分)并将其存储在数字媒体上之后,可以使用主机或辅助计算机上可用的大量图像处理软件包进行分析。
共聚焦显微镜的优缺点
激光扫描共聚焦显微镜的主要优点是能够通过厚度不超过50um或更大的荧光样品连续生产薄(0.5至1.5um)的光学切片。通过将显微镜精细聚焦机制中的增量变化(使用步进电机)与每个步骤的顺序图像采集进行协调来收集图像系列。图像信息被限制在一个定义良好的平面上,而不是由于样品中偏远位置产生的信号而变得复杂。由于减少了背景荧光和改善了信噪比,对比度和清晰度比宽视场技术有了显着改善。此外,光学切片消除了传统形式显微镜在组织切片的物理切片和荧光染色过程中出现的伪影。非侵入式共聚焦光学切片技术可以在各种条件下以更高的清晰度检查活体和固定标本。
使用大多数共聚焦显微镜软件包,光学部分不仅限于垂直的横向(x-y)平面,还可以在横向平面中收集和显示。大多数共聚焦软件程序都可以轻松生成x-z和y-z平面中的垂直截面(平行于显微镜光轴)。因此,样本看起来好像是在垂直于横轴的平面中进行了剖分一样。实际上,垂直截面是通过组合沿z方向进行的一系列x-y扫描获得的 然后将其投射到软件上,然后投射出荧光强度的视图,如果显微镜硬件已经能够物理执行垂直截面的话,将会出现荧光强度的视图。
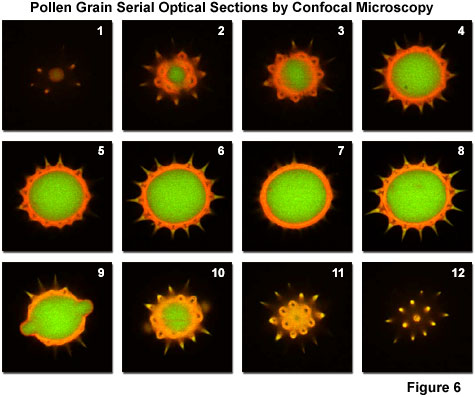
典型的光学部分堆栈(通常称为Z系列))穿过向日葵花粉粒,揭示出自发荧光发射波长的内部变化,如图6所示。使用双氩离子(488nm;绿色)以垂直于z轴(显微镜光轴)的0.5um步长收集光学部分。荧光)和绿色氦/氖(543nm;红色荧光)激光系统。该物种的花粉颗粒直径在20到40um之间,在宽视野荧光显微镜下(见图1(c))产生模糊的图像,这些图像缺乏有关内部结构细节的信息。虽然在该系列中收集的48张图像中仅显示了12张,但它们代表了分开约3um距离的单个焦平面,并很好地指示了内部晶粒结构。
在比花粉颗粒更复杂的标本中,很难通过激光扫描共聚焦显微镜从标本的体积顺序获取的一系列光学部分中辨别出复杂的相互连接的结构元素。但是,一旦收集了足够的一系列光学部分,就可以使用体积渲染计算技术将其进一步处理为标本的三维表示。现在,这种方法已普遍使用,以帮助阐明生物学研究中细胞和组织的结构与功能之间的众多相互关系。为了确保收集到足够的数据以生成具有代表性的体积图像,应在适当的轴向(z步)间隔,以便在图像中反映出样品的实际深度。
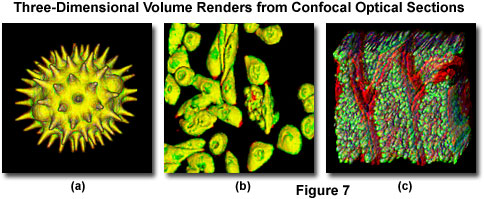
商用共焦仪器随附的大多数软件包都能够生成从z系列图像堆栈获取的光学截面数据的复合视图和多维视图。三维软件包可用于创建标本的单个三维表示(图7)或从标本体积的不同视图编译的视频(电影)序列。这些序列通常模仿旋转或类似空间变换的效果,从而增强了对标本三维特征的欣赏。此外,许多软件包使研究人员能够测量长度,体积和深度,以及图像的特定参数,例如不透明度,
图7显示了通过连续光学切片检查的几个样品的典型三维表示。将图1和图6中所示的花粉粒光学切片组合在一起,可以产生外表面的真实视图(图7(a))。如果用扫描电子显微镜检查,可能会出现。用于构建三维模型的算法使用户可以将花粉粒旋转360度进行检查。图7(b)中的组织培养细胞源自中国仓鼠卵巢(CHO)系,并用含有绿色荧光蛋白和人类免疫缺陷病毒(HIV)的嵌合质粒载体转染)在细胞核中表达的蛋白质(因此,标记了核区域)。厚组织切片也很容易在由光学切片构成的三维图中查看。图7(c)所示的小鼠肠部分用几个荧光团标记,并由45个光学部分的堆叠组成。
在许多情况下,组合视图或投影视图由一系列光学部分产生的图像提供了比三维视图重要的有关三维样本的信息。例如,由于离焦模糊,使用宽视野技术难以(如果不是不可能)在组织切片中具有荧光标记的神经元成像(如果不是不可能的话)。同一神经元的共聚焦薄切片每个都显示出几个延伸的部分,但是这些通常表现为碎片状的条纹和点,并且缺乏连续性。通过展平神经元的一系列光学区域而创建的合成视图将以清晰的连续性清晰地显示所有扩展过程。与三维体积渲染技术相反或与之结合的其他视图也可从其他视图中受益,从而可以对其他细胞和组织切片进行结构和功能分析。
共聚焦显微镜的发展使得活细胞和组织的多维视图成为可能,其中包括x,y和z中的图像信息。尺寸作为时间的函数,并以多种颜色显示(使用两个或多个荧光团)。在对单个图像堆栈进行体积处理之后,可以将所得数据实时显示为三维多色视频序列。请注意,与常规的宽视野显微镜不同,使用共聚焦显微镜可以对所有标记了多个标本的荧光染料进行对准。可以从长时间进行的延时实验中收集时间数据,也可以在较短的时间内通过较小帧中的实时图像采集来收集时间数据。随着开发出新的激光系统来限制细胞损伤以及计算机处理速度和存储容量的提高,使用多维共聚焦显微镜作为细胞生物学强大工具的潜力正在不断增长。
扫描共聚焦显微镜的其他优点包括无需改变物镜就可以通过改变激光扫描区域来电子调节放大倍数的能力。此功能称为缩放系数,通常用于通过更改扫描激光采样周期来调整图像空间分辨率。增大缩放系数会减少扫描的样本面积,同时会降低扫描速率。结果是沿可比较的长度增加了样本数量,这既增加了图像空间分辨率,又增加了主机监视器上的显示放大率。当使用低数值孔径和放大物镜收集数据时,通常使用共焦变焦将数字图像分辨率与显微镜的光学分辨率相匹配。
共聚焦显微镜光电倍增管(或类似检测器)收集的顺序模拟图像数据的数字化,通过将连续的电压流转换为与光强变化相对应的离散数字增量,从而促进了计算机图像处理算法。除了处理数字数据带来的好处和速度外,还可以轻松准备图像以进行打印输出或出版。在精心控制的实验中,也可以从数字数据中获得空间荧光强度的定量测量结果(静态的或作为时间的函数)。
共聚焦显微镜的缺点主要限于普通激光器(称为激光线)可用的有限激发波长数量。)发生在非常窄的谱带上,并且在紫外光区生产昂贵。相比之下,常规的宽视野显微镜使用基于汞或氙气的弧光放电灯在紫外,可见和近红外光谱区域提供全范围的激发波长。另一个缺点是高强度激光照射对活细胞和组织的有害性质(最近,多光子和Nipkow圆盘共聚焦成像解决了这个问题)。最后,购买和操作多用户共聚焦显微镜系统的高昂成本可能会比同类的宽视野显微镜高出一个数量级,这常常限制了它们在较小实验室中的应用。通过为核心设施中一个或多个部门提供服务的分担成本的显微镜系统可以轻松解决此问题。个人共聚焦系统的最新推出竞争性地降低了低端共聚焦显微镜的价格,并增加了个人用户的数量。