

- 您好,欢迎您访问成贯仪器官方网站!


术语“光操纵”描述了各种各样的技术,这些技术使显微学家能够通过提供一种通过目标照明与样本互动的方式,从事件的被动观察者转变为激发者。通常,研究人员试图观察感兴趣的特定过程,以便了解潜在的生物学过程。显微镜专家常常被迫在大量细胞中搜寻或获取数小时的时间片段,然后才能观察到感兴趣的事件,而且在许多情况下,仅使用常规显微镜技术根本无法观察某些过程。借助光操纵工具,显微镜医师可以启动生物事件,从而精确调整样品标签,生物活性,当地化学环境,在某些情况下会物理破坏其样本的一部分。当揭开复杂的,分隔的生物机制时,这些功能非常有价值。光电操纵工具使用户能够设计高级实验,以访问其标本中的其他信息层,这是仅凭观察无法获得的。
光漂白是一种光化学过程,通过该过程,荧光团的强大激发使其永久无法发出荧光。荧光团所附着的蛋白质仍具有生物活性,有效地使用户能够产生2个不同的蛋白质种群(荧光/非荧光)。F字描述了一系列技术,这些技术包括使用短时间的定向照明猝灭荧光团,然后记录剩余标记种群的重新分布。这些技术使用户能够定量研究亚细胞结构中标记蛋白的间隔和周转。
光漂白后的荧光恢复(FRAP)涉及漂白掉部分标记,并通过未漂白的蛋白质迁移到漂白区中记录目标区域中荧光信号的恢复(图1)。恢复曲线的绘制使用户能够量化恢复率并区分单相和多相恢复曲线。该技术使用户能够探索感兴趣结构的翻转和分隔。用荧光蛋白进行荧光标记只能让您观察蛋白的位置。它不允许您窥视看似实心的标记对象(囊泡/细丝),以了解分子如何在结构内移动和翻转。除此之外,对象的内部动力学可能会在细胞的不同区域发生变化,也可能会响应诸如细胞因子或病原体的外部刺激而发生变化。简而言之,FRAP仍然是一种非常有用的技术,可用于研究细胞内部结构的可塑性和周转率以及相互连接性(图2)。
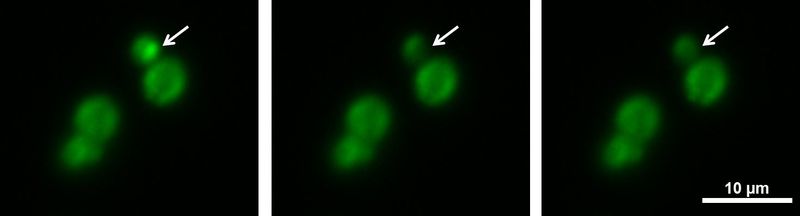
图1:酵母细胞中的FRAP实验。这些酵母细胞的P体带有荧光标记的蛋白质。在FRAP实验过程中,可以漂白小结构,并且可以观察到回收率(箭头)。
光漂白(FLIP)中的荧光损失是另一种可以称为反向FRAP的漂白技术。随着时间的流逝,目标区域被反复漂白,并在每个漂白周期后获取图像。与FRAP寻求目标区域内的荧光恢复不同,FLIP则关注整个细胞其余部分的信号稳定损失。该技术揭示了分子在整个细胞中的移动性,并使用户能够识别多个细胞区室中高和低周转的区域。该技术可用于观察蛋白质(例如细胞角蛋白)的复杂转换途径,否则这些途径可能并不明显。而FRAP FLIP使您能够观察特定区域内的周转率,FLIP使您能够观察整个细胞中分子的周转率和间隔。
福斯特共振能量转移(FRET),也称为荧光共振能量转移,是一种将能量从一种荧光团转移到另一种荧光团的过程,可用于测量分子间和分子内的距离。FRET仅在极短的距离(通常为1-10 nm)内发生,因此可用于量化和绘制细胞内的结合和蛋白质相互作用。激发后,供体荧光团将能量转移到受体荧光团,然后通常以比供体更长的波长发射。FRET的效率通常使用比例成像或通过供体荧光寿命成像(FLIM)的变化来测量。什么时候发生FRET,施主发射被淬灭,受主发射通道增加。在FRET受体光致漂白中,受体在目标区域被漂白,因此FRET不再发生,从而消除了供体的猝灭。供体信号的增加(去猝灭)可用于直接测量FRET效率。
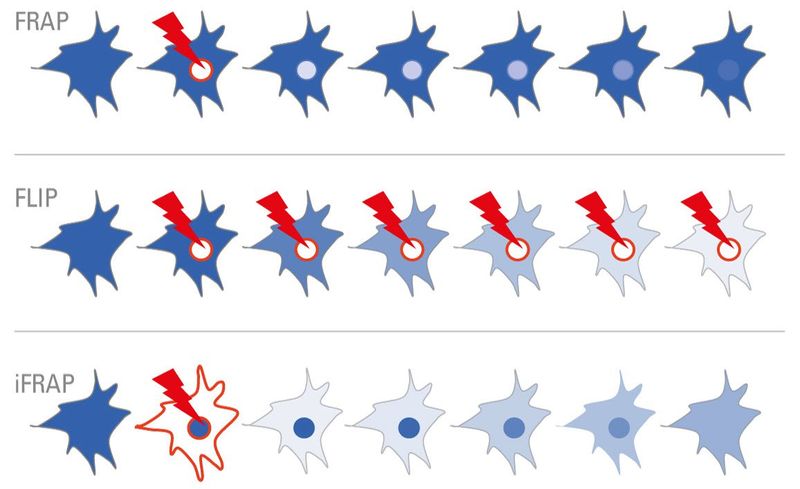
图2:图1:在光致漂白(FRAP)后的荧光恢复过程中,蛋白质的荧光标签被感兴趣区域(ROI)内的强大激发所漂白。随后的重新安置可以洞悉感兴趣的结构的营业额。对于光漂白(FLIP)中的荧光损失,要重复漂白细胞内的ROI。漂白的分子散开并且荧光的丧失表明例如细胞器是否物理连接。在反向FRAP(iFRAP)期间,ROI外部的细胞区域被漂白。随后,未漂白的分子散开并可以被监测。
与通过光漂白破坏染料的荧光特性相反,光操纵也可以用于激活许多光敏荧光蛋白。许多荧光团具有在特定波长下照明时在不同分子状态之间切换的能力,这种特性称为光致变色。光致变色使荧光团能够在低荧光状态和高荧光状态之间切换(光活化),或在刺激时改变其发射光谱(光转换)(图3)。
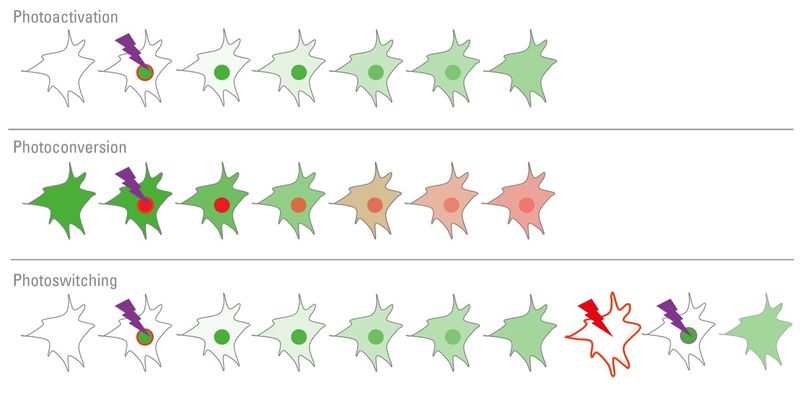
图3:光活化,光转化和光转换可用于跟踪蛋白质随时间的变化。光活化蛋白可以通过一定波长的光“打开”。光转换蛋白可以改变其发射光谱,而光转换蛋白可以打开和关闭很多次。
光转换的一个众所周知的例子是mEOS,它在405 nm激活后呈现绿色到红色的转换,其发射峰从516 nm变为581 nm。可光活化的蛋白使用户能够跟踪一种蛋白的两个不同的群体(激活/未激活),而光可转换蛋白在尝试查看多个标记蛋白时会很有用。光可切换的荧光蛋白表现出可逆的光致变色现象,并且能够在不同状态之间反复循环,从而使用户可以打开和关闭它们(例如Dronpa)。有关更多信息,请参见可光活化,可光转化和可光切换的荧光蛋白。
当与光操作一起使用时,光致变色的主要用途是跟踪随时间变化的活化蛋白种群。
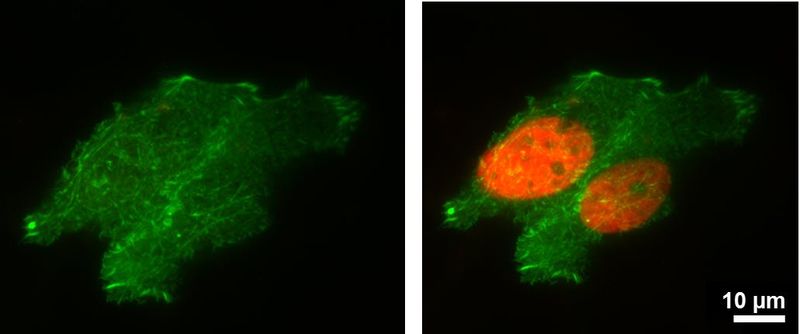
图4:对于该光活化实验,用pamCherry-H2B和eGFP-Actin转染HeLa细胞。光活化后,pamCherry呈现出明亮的荧光。
值得注意的是,表现出光致变色现象的荧光团也可以用于单分子定位超分辨率技术,例如sptPALM和fPALM。一旦产生了光开关融合蛋白,它通常可以用于多种互补技术。
当试图观察大量表达的蛋白质的行为时,光致变色蛋白质特别有用。例如,可光活化的荧光团使用户能够轻松地在其他拥挤的环境中跟踪特定对象。当尝试使用较长的间隔时间间隔以减少光应力时,尝试跟踪单个对象时,此方法可能很有用。光敏荧光团还使用户能够观察到不同细胞区室之间的扩散,或检查可塑性并翻过看似坚固的内部结构,例如细胞骨架丝。该技术使用户能够观察相邻对象之间是否发生子单元交换。此外,该技术使用户能够研究从囊泡融合和分裂到子细胞的位置和身份的物体谱系。最后,光致变色蛋白也可以用于脉冲追踪实验,通过该实验,细胞中的所有蛋白都可以转化,从而使用户能够区分光操纵事件前后产生的蛋白。最后,一些可光转换的蛋白质也可以用作光遗传学致动器,从而除了转换染料的荧光特性外,发生的构象变化还可以用于转换其他共轭生物分子的活性。
重要的是要仔细考虑您的应用并选择适合您要求的正确的荧光蛋白(FP)。一些可光活化的FPs比其他可激活的FPs明显亮得多,例如,激活后的paGFP显示亮度增加了约100倍,而像Kaede这样的蛋白质则显示了2000倍的亮度增加。较亮的FP使用户能够跟踪少量蛋白质,或者使用户能够以低得多的激发设置获得可比的信噪比水平,从而将光毒性降至最低。还值得注意的是,光转化蛋白比光活化蛋白更容易使用,因为它们在活化之前就固有可见。相反,他们需要为一个蛋白质群体使用两个成像通道,因此计划在一个实验中对多个蛋白质成像的用户最好使用可光活化的蛋白质。
除了控制荧光标记的特性外,还可以通过通常称为光遗传学的过程,利用光敏蛋白结构域,通过光操纵来选择性激活生物途径。光遗传学工具使用户能够以高度针对性的方式刺激命令细胞。经典的光遗传学涉及光敏离子通道的靶向活化,以改变膜电压电位。最著名的光遗传学效应子属于视紫红质家族。视紫红质是非特异性阳离子通道,但是自从发现或工程化阴离子传导性视紫红质以及离子特异性通道以来。激活的下游效应可以使用电生理学或通过光学传感器(例如比例钙染料)进行测量。光敏离子通道是非常有价值的工具,因为它们允许对神经元和其他细胞类型进行高时空分辨率刺激。还值得注意的是,G蛋白介导的信号的光学控制也是可能的。
除了基于受体的经典光遗传学致动器外,还出现了具有发现或许多其他光敏蛋白结构域的完整的光遗传学工具套件。可以将光敏结构域(例如植物的光,氧,电压(LOV)域,植物色素或隐色色素)改造成效应蛋白,使研究人员可以将光遗传学致动器中的几乎任何他们想要研究的蛋白质都构建在内。LOV域暴露于蓝光会导致构象变化。通过一些深思熟虑的蛋白质工程,这种变化可用于激活或失活目标靶蛋白。LOV域可用于诱导靶向的DNA结合,蛋白质二聚化和酶激活或失活。
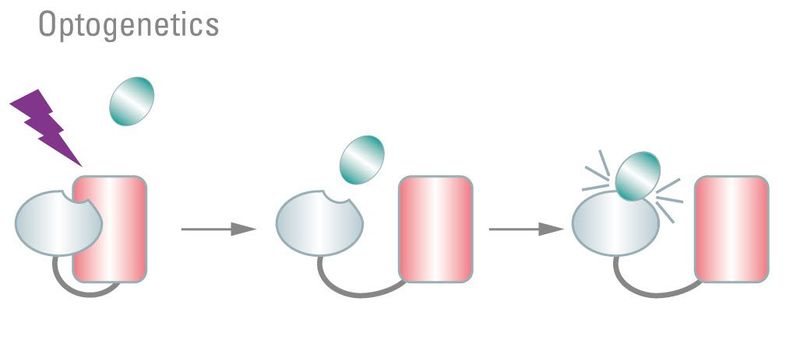
图5:光遗传学利用光敏蛋白结构域触发细胞机制。经典地,使用光敏离子通道来改变膜电位。同时,已经驯化了其他蛋白质,这些蛋白质在光照后显示构象变化。这可用于激活或失活靶蛋白,例如诱导蛋白表达。DNA结合或酶激活。
使用LOV域的一个示例是使用它来产生光敏RAC激酶。激活使该小组能够有效控制细胞运动。有趣的是,甚至在CRISPR / Cas9等基因编辑工具的购买下,也都在光学控制下,通过添加名为Magnets的可光诱导二聚结构域来实现光学靶向基因的编辑。新兴的光遗传学工具套件为新的研究途径提供了巨大的潜力。
除了用于调节蛋白质活性或染料的荧光状态外,光操纵还可用于操纵样品本身的物理和化学状态。通过用大功率脉冲激光器代替通常用于成像的连续波激光器,就可以物理破坏样品的一部分或诱导样品内部和周围的化学试剂发生光解。通过切割和消融,根据施加到样品的功率,效果可能会有所不同,从切割单个细胞骨架纤维或截取部分细胞直至完全消融细胞簇(图6)。此功能可用于多种不同的应用程序,使用户能够研究生物体对创伤的反应方式并投资涉及修复的下游生物途径。从探索单个微管在有丝分裂中的作用,这些功能具有广泛的应用直至伤口愈合,炎症和转移过程的背后机制。消融可用于在组织中形成伤口,使研究人员能够探索信号传导途径,细胞迁移以及复杂的多细胞过程所涉及的动力学。在发育生物学中,消融可用于敲除部分胚胎,以了解对整个生物体发育和组织的影响。

图6:为研究神经元再生能力,可借助脉冲激光(箭头)切割轴突。切除和切割实验的范围从切割整个细胞或细胞碎片到单个细胞骨架成分。由英国剑桥大学的Richard Eva提供。
此外,可以使用光操纵技术以高度靶向的方式将生物活性化合物引入样品中。许多有机化合物在暴露于紫外线时会发生光解。使用有机化学合酶,可以设计完整的生物惰性化合物,但暴露于紫外线下会降解为生物活性化合物。这些化合物被称为笼状化合物,这些化合物的定向光解被称为开笼。。开盖的普遍用途是在神经生物学中,可将其用于将活跃的神经递质引入单个突触连接中。迄今为止,各种各样的笼状化合物是可商购的,包括神经递质(例如谷氨酸和GABA),核苷酸(例如ATP和cAMP),离子(例如钙),甚至一些大分子(图7)。分子,例如蛋白质,肽,DNA和RNA也可以用可共价修饰特定残基的可商购试剂封闭。
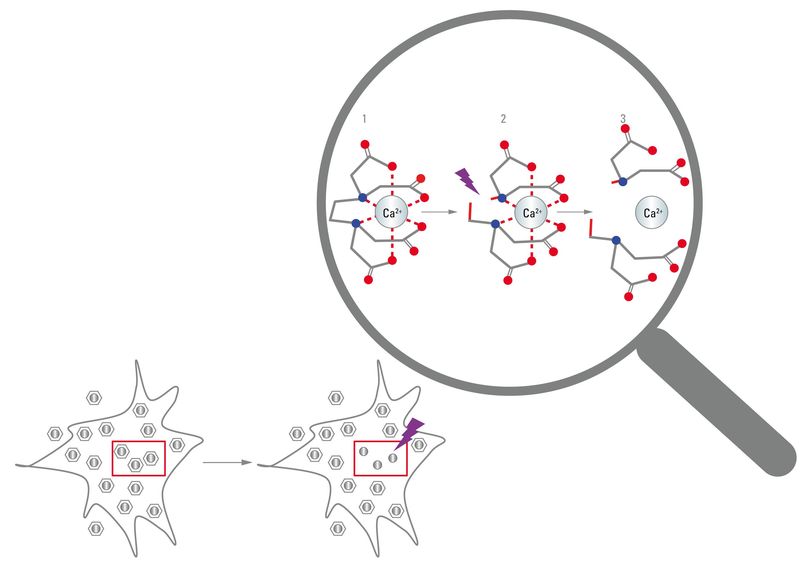
图7:开笼:化学封装的生物活性物质(例如钙离子)被称为笼状化合物。在紫外线的帮助下,螯合剂可能会被破坏,从而导致笼中化合物的释放。
除了使用光操纵物理破坏样品中的物质外,还可能对细胞造成非常特殊的损害。一个这样的例子是使用紫外线激光将靶向的断裂引入DNA。该技术可用于触发和研究细胞DNA修复机制。参与识别和应对DNA损伤的许多蛋白质在癌症的发展和治疗中都起着关键作用,因此按需激活这些途径的能力提供了极为有价值的癌症研究工具。
光电操纵技术提供了一套极其通用的研究工具,以及已经描述的应用程序,光电操纵工具箱还提供了其他一些鲜为人知的功能。这些措施包括使用红外激光将定向的热应力引入细胞。光电操纵装置也可用于微图案包括蛋白质印刷和蚀刻到玻璃上以产生用于相关显微镜的标记物的基底。多光子激光器还可以用于一系列光操纵技术,例如切割,开卷,光开关和刺激,其主要优点是改善了3D瞄准能力。最后,还值得一提的是,可以结合使用诸如漂白和激活标记物(如mEOS)之类的技术来深入了解某些复杂过程。此外,漂白和活化技术可用于研究通过开孔或光遗传学致动器在靶向刺激之前和之后发生的动态过程中的变化,或探索细胞对切割或消融事件对创伤的反应。
有几种不同类型的技术可用于光操纵,它们各有优缺点(参见图8)。最简单的方法是在荧光路径中使用视场光阑,以特定的波长照亮视场的中心,然后再次打开视场光阑并切换用于成像的波长。这种方法速度慢,定向灵活性差,并且仅提供低功率照明,因此不适用于大多数实验。但是,它足以进行基本的光活化,并可以用来测试构建体的活性。由于大多数光操纵实验都需要更强大的照明,因此激光通常是首选的照明光源。激光设备,例如Leica WF FRAP为基础FRAP实验提供了出色的工具。强大的激光源瞄准图像的中心,可以使用光罩修改样品中光束的轮廓,使用户能够拍摄有限范围的ROI大小和形状。这些设备的局限性在于它们通常仅提供一条激光线,从而限制了它们可用于的实验类型。另一个限制是,由于它们无法通过单个实验来针对多个或复杂的ROI,因此许多实验超出了此类设备的能力范围。
更高级的光操纵实验通常需要具有以一定波长范围反复瞄准样品中任何区域的能力。提供此功能的主要技术有两种,即数字镜设备(DMD)和振镜扫描设备。数字镜设备使用包含数千个微镜的芯片,这些微镜可以通过高速电子方式切换到打开或关闭位置。整个芯片使用激光或LED照明,根据激活的反射镜的图案,用户可以将复杂的照明图案投射到样品上。DMD使用户能够同时照明多个感兴趣的区域。DMD的主要缺点是它们能够实现的相对较低的最大功率密度,因为照明光散布在整个视场中。这使得DMD在某些应用中(例如某些光遗传学应用)非常有用,但它们却在诸如漂白,切割和烧蚀之类的高速功率饥饿应用中挣扎。振镜扫描装置使用高速振镜扫描仪在样品上引导聚焦的激光束,使它们成为最通用的光操纵装置。Galvo扫描仪通常作为独立的光处理设备来使用,但也可以使用许多共聚焦扫描仪。取决于耦合的激光器,它们几乎可以满足任何应用。衍射受限光束的使用使振镜装置能够非常有效地漂白和激活。它们还可以用于切割和消融应用。一些振镜扫描仪还可以调整其光束轮廓,使用户在设计实验时具有更大的灵活性。取决于耦合的激光器,它们几乎可以满足任何应用。衍射受限光束的使用使振镜装置能够非常有效地漂白和激活。它们还可以用于切割和消融应用。一些振镜扫描仪还可以调整其光束轮廓,使用户在设计实验时具有更大的灵活性。取决于耦合的激光器,它们几乎可以满足任何应用。衍射受限光束的使用使振镜装置能够非常有效地漂白和激活。它们还可以用于切割和消融应用。一些振镜扫描仪还可以调整其光束轮廓,使用户在设计实验时具有更大的灵活性。
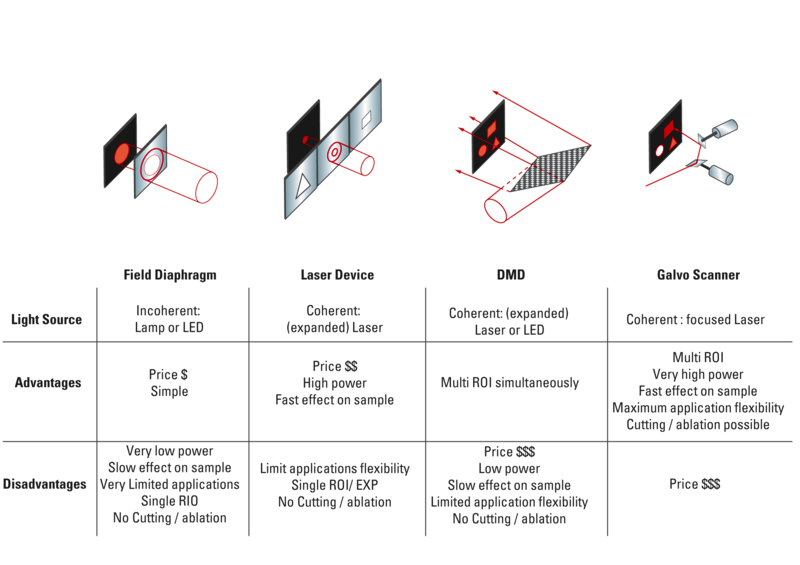
图8:用于光操纵实验的硬件选项。
重要的是要考虑到光操纵设备只是整个系统的一部分,因此从光学和软件角度都应考虑将该设备集成到系统中的程度。集成良好的设备不应影响光路,软件应支持成像和操作任务的无缝隔行扫描。还应考虑操作简便性与设计复杂高级实验方案的能力。
总而言之,由于光操纵功能可以提供的广泛功能,它们为任何活细胞成像系统提供了极为强大的功能。通过光漂白和活化技术,光操纵可用于在样品上实现多种效果,从而使用户能够发现原本隐藏的动态过程。现在,光遗传学的快速发展和迅速发展使用户能够以亚细胞分辨率和ms精度刺激或抑制几乎任何生物途径。最后,切割和消融技术使研究人员能够对样品进行显微手术。这些功能与现代成像系统结合在一起,为在广泛的研究领域中加深我们的理解提供了巨大的潜力。