

- 您好,欢迎您访问成贯仪器官方网站!


在仪器开发的早期阶段,对全光谱范围内的光学配置进行了仔细检查,以进行全内反射荧光显微镜(TIRFM)。通过这种努力,出现了许多设计,这些设计满足了在具有不同折射率的两种材料之间的接合处产生薄渐逝场的要求。
这些设计中的大多数都集中在倒置显微镜上,这主要是由于在笨重的显微镜台架上方而不是下方添加TIRFM光学元件很方便。还可以使用立式显微镜配置,尤其是当这代表实验条件或研究者预算的唯一实用选择时。用直立显微镜观察在塑料陪替氏培养皿底部单层培养中生长的细胞与细胞底物接触的情况,特别是在使用带有浸入锥的水浸物镜的情况下,更适合进行TIRFM。
不管基本的显微镜设计如何,大多数当前使用的TIRFM配置都依靠附加的棱镜将激光照射引向发生全内反射的界面,该界面位于显微镜的标本共轭平面内。也可以使用显微镜物镜同时将照明引导至界面并捕获由激发荧光团产生的二次荧光发射。该讨论回顾了TIRFM的许多基本显微镜配置,并假设示例样本由组织培养中的细胞组成,这些细胞用一种或多种荧光染料标记,并在附着于玻璃盖玻片的单层中在全内反射界面处生长。
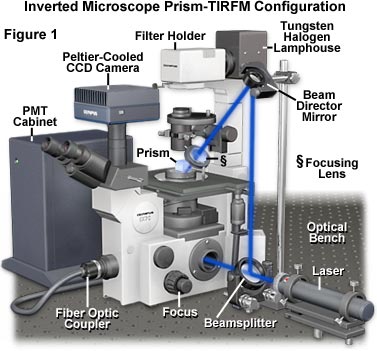
图1所示为典型的TIRFM仪器配置,包括倒置组织培养显微镜,梯形棱镜块,外部激光照明和光电倍增器/ CCD组合检测器系统。激光发出的蓝光首先通过扩束器,然后进入分束器,该分束器在显微镜入口和光束指向镜之间进行分光。从导向镜的表面反射后,一部分光线被聚焦透镜聚焦到位于样品台和物镜正上方的显微镜台上的梯形棱镜上。棱镜以比全内反射的临界角稍大的角度将照明引导到TIRF界面,从而产生使样品中的荧光团激发的van逝场。分束器通过的另一部分光进入显微镜端口,在此可以将其通过光学系统引导至标本,以进行宽场落射荧光激发。样品发出的二次荧光被物镜收集,并传递到目镜,CCD摄像头系统或光电倍增管(PMT)。由于梯形棱镜的顶部是平坦的,因此可以使用多种对比增强技术,包括微分干涉对比,相位对比,暗场和霍夫曼调制对比,利用钨卤钨灯房的照明以透射模式观察样品。可以将其通过光学系统引导至标本,以进行宽场落射荧光激发。样品发出的二次荧光被物镜收集,并传递到目镜,CCD摄像头系统或光电倍增管(PMT)。由于梯形棱镜的顶部是平坦的,因此可以使用多种对比增强技术,包括微分干涉对比,相位对比,暗场和霍夫曼调制对比,利用钨卤钨灯房的照明以透射模式观察样品。可以将其通过光学系统引导至标本,以进行宽场落射荧光激发。样品发出的二次荧光被物镜收集,并传递到目镜,CCD摄像头系统或光电倍增管(PMT)。由于梯形棱镜的顶部是平坦的,因此可以使用多种对比增强技术,包括微分干涉对比,相位对比,暗场和霍夫曼调制对比,利用钨卤钨灯房的照明以透射模式观察样品。
在设计TIRFM实验时,配置图案中要考虑的最重要因素是照明的临界角。通常在其上生长组织培养细胞的普通玻璃盖玻片的折射率约为1.52,而围绕细胞和内部细胞成分的介质的折射率范围为1.33至1.38。因此,要在细胞膜和盖玻片之间的界面处获得全部内部反射(n(2/n(1)=1.52/1.38),入射角必须大于65度的临界角。如果细胞不是完整的并且已被透化,溶血,超声处理或固定,则较低的折射率是水性缓冲液的折射率(n(1)=1.33)而不是细胞质,临界入射角减小到61度。
原则上,可以使用常规的卤素钨灯或汞/氙弧灯进行TIRFM实验,但是文献中报道的大多数研究都是在激光照射下进行的。如此广泛使用激光的主要原因是激光是相干,偏振和良好准直的,因此可以使用标准的扩束镜,反射镜和聚焦透镜将其轻松地对准物镜或棱镜。当激光源正确对准后,全内反射界面将被定义为可轻松调整以适应实验变化的几何形状区域照亮。对于需要大量照明的实验,高强度激光源也很重要,
用于TIRMF实验的最流行的激光源是1到3瓦特的空气和水冷连续波氩离子系统,该系统在488和514纳米处具有很强的发射谱线,能够激发多种常见的荧光团。具有较长波长的线的激光器,例如氦氖和and离子气体激光器,可以用来激发在540纳米及更高区域吸收的荧光团。但是,实际上任何可见光总输出在0.5瓦特或更大范围内的激光器都应该是足够的。对于TIRFM,激光源通常比弧光灯更可取,因为对由弧光灯发出的光进行准直会导致强度大大降低。但是,激光照射会在样品上产生不可避免的干涉条纹,通过仔细清洁光学表面可以在某种程度上减少这种情况。对于关键实验,研究人员应探索激光的快速抖动,或至少使用由均匀浓度的荧光团组成的控制数字图像来计算样品数字图像的归一化。
倒置显微镜配置
从倒置显微镜上的培养室获得全内反射的最简单方法是直接通过位于培养室顶部的玻璃立方体进行激光照射,如图2所示。通常,使用固定平台显微镜(其中的物镜转换器在其中) /物镜组合在聚焦过程中被转换)比可移动平台显微镜更方便。这种配置可确保样品在聚焦过程中保持静止,仅需激光束的初始对准即可。但是,移动式显微镜更常见,并且这些实验都可以使用两种类型。
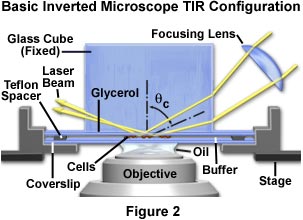
在这里考虑的所有倒置显微镜配置中,充满缓冲液的样品室包括一个下部裸露的玻璃盖玻片,一个60微米厚的Teflon间隔环和倒置的细胞粘附盖玻片,因此细胞向下朝向显微镜物镜。这种设计的优势在于,未与底物结合的细胞,疏松的细胞碎片和污染性蛋白质倾向于以聚集体的形式沉淀到腔室的底部,而不会遮挡或向外部内部反射界面添加多余的荧光。
通过浸没油或甘油的薄层将细胞单层-盖玻片组合的上表面与玻璃块(或棱镜)光学接触。玻璃块的侧面应固定,但样品必须能够在x和y方向上平移,同时仍保持光学接触。下盖玻片可能尺寸过大,并且特氟隆垫片通常带有间隙,因此浸入细胞的缓冲溶液可通过带有入口和出口的毛细管作用而改变(图2和3)。一些制造商提供专门为此物镜设计的组织培养室。
如图2所示,激光束首先进入倾斜放置在显微镜镜台上方的聚焦透镜。透镜的物镜是在落射照明过程中以与物镜几乎相同的方式集中激光照明,但是透镜也可以使光束宽度变窄,以便于对准。透镜的焦距不是关键性的,可以在50到100毫米之间,但是应使研究人员能够在狭窄范围内轻松更改照明区域的大小。与照明系统中的其他组件一样,聚焦透镜应安装在xyz平移器上,其轴之一与入射激光束方向对齐。转换器可以安装在实验室工作台或显微镜载物台上,但是将其安装在载物台上时更易于对准。
三个主要光学元件在进入聚焦透镜之前控制并引导激光束的大小和路径(请参见图1)。这些组件包括一个扩束器,用于在离开腔室时使激光束变宽,一个分束器(可选)或反射镜,以及一个用于将光束转移到聚焦透镜中的光束导向器。
激光扩束器可从许多分销商处广泛获得,并用于控制聚焦透镜处的光束宽度。结果,然后由聚焦透镜确定在样品上的会聚角和聚焦点的宽度。当激光束遇到立方体的垂直面时,会在光束轮廓上以一系列角度折射。所得的几何像差在界面处产生椭圆形照明的区域,当与具有高斯轮廓的平行光束的预期图案相比时,椭圆形的照明区域变长。进入聚焦透镜的光束越宽,产生的反射点的尺寸越薄。在最佳条件下,可获得接近2.5微米下限的光束半宽。
分束器是一面镜子,它将水平激光束转向垂直方向(成90度角),以将其提升到超过显微镜载物台和玻璃棱镜或玻璃块的高度。应使用可调节的光学安装座来容纳分束器,以便可以将其拆下,以允许激光直接进入显微镜端口,以便快速且可逆地转换为辅助落射照明。通过使用部分镀银的镜子甚至是平玻璃载片作为分束器,可以同时观察落射照明和内部全反射。
使用光束导向镜将激光束从垂直方向倾斜向下朝聚焦透镜倾斜(请参见图1)。反射镜的高度决定了全内反射表面的入射角。除线性高度调整外,还应将导向镜安装在双轴旋转安装座上,以使未聚焦的激光束指向棱镜。如果将镜架安装在移动平台显微镜的平台(而不是实验室工作台)上,则在聚焦样品时可以使反射区域的位置对变化不敏感。
正确对准后,经过准直和聚焦的激光束进入玻璃立方体,并被折射引导以入射角超过临界最小值的方式入射到全内反射界面(在立方体的下表面下方)。立方体的大小和形状都不是至关重要的,棱镜或矩形玻璃块很容易替换。等边棱镜和45-45-90度棱镜是标准的商业商品,可以从多种渠道购买。具有平坦顶部的棱镜(图2和图4),例如上述立方体或截头三角形,可以在棱镜上方放置卤钨灯和聚光系统。在这种配置下,常规的照明技术(例如明场,暗场,相位对比,
要安装棱镜或玻璃块,将一滴纯甘油或浸油涂在培养室的上表面,然后将棱镜缓慢降低到涂油的表面上,从而将液滴散布成薄层。接触介质(甘油或油)有两个物镜:确保棱镜和样品室之间的光学接触,以及机械润滑两个玻璃表面之间的区域。由于样品室在扫描过程中横向移动,棱镜或玻璃块保持固定。入射激光束应倾斜地传播通过棱镜的下部,然后传播通过甘油或油层,最后通过样品,在显微镜的光轴正上方的基板底面上全反射。基材厚度并不严格,
应谨慎使用浸入式接触介质(油或甘油),因为任何多余的物质都可能积聚在棱镜的下边缘,并在棱镜首次进入玻璃时干扰入射的激光照明。棱镜的大小并不严格,但是较大的棱镜可能会阻止样品的横向运动,尽管它们会增加浸入介质珠和入射光束之间的间隙。通常,理想的是表面积为大约平方厘米的棱镜或玻璃块。
用于将激发激光耦合到系统中的棱镜不需要与发生全内反射的载玻片或盖玻片的折射率完全匹配。它们可以与甘油,环己醇或显微镜浸油以及其他光学上不同的液体进行光学偶联。浸油具有较高的折射率,这有助于避免在低入射角下棱镜/耦合介质界面处可能发生的全内反射。但是,许多品牌的浸油显示出大量的自发荧光。另一个重要的一点是,截顶的棱镜表面不需要特殊的抛光处理,但可以在标准的商用显微镜载玻片的光滑度上充分发挥作用。
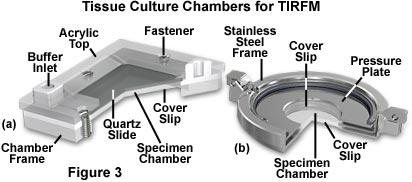
图3中显示了几种利用玻璃载玻片和/或盖玻片组成的窗口的标本室设计。在左侧(图3(a))是Tamm室,其设计物镜是提供薄的轮廓,以便观察组织培养细胞通过一薄层缓冲溶液,可以使用焦距很短的高数值孔径物镜。在上玻璃盖玻片(或显微镜载玻片)上生长的单层细胞与下盖玻片用厚度小于100微米的薄垫片隔开。进入孔使细胞可以用各种溶液进行灌注,以进行滴定,平衡结合实验或细胞表面相互作用的动力学分析。类似的设备Dvorak-Stotler受控环境培养室,如图4(b)所示。该腔室还使用盖玻片作为顶部和底部窗口,但没有检修孔或任何机制以允许添加化学药品或更改缓冲溶液。
如图3所示,标本室包含维持培养细胞所需的缓冲水溶液。将该溶液夹在基材表面和玻璃盖玻片之间,该玻璃盖玻片由氯丁橡胶或特氟隆垫片隔开。特氟龙环是可商购的,其厚度范围从50微米起。如果要使用数值孔径大且工作距离短的高倍物镜,则缓冲溶液的深度必须非常薄。在许多情况下,玻璃棱镜在基板上的向下压力足以在不进行额外夹紧的情况下密封样品腔,但是许多腔室设计(图3)都包含固定基板和玻璃盖玻片的机构。
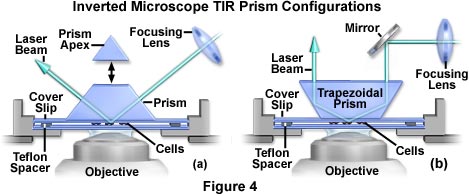
在使用棱镜(与玻璃块相反)以实现全内反射的情况下(参见图4(a)),通过从水平方向引入激光束来获得最大入射角。对于标准玻璃(折射率为1.52),直角棱镜的最大入射角为73度,等边棱镜的最大入射角为79度。相差和其他透射光技术与该配置不兼容,因为三角棱镜的上表面不平坦。但是,对棱镜顶部进行定制的截断和抛光(在图4(a)中作为选项提供)会产生一个表面,该表面可以很容易地通过倒置显微镜聚光镜系统从上方通过入射光。
当安装在显微镜聚光镜上时,一个60度梯形棱镜(图4(b))是倒置仪器上方的台上TIRFM开发的最方便和可重复的配置。入射的激光束是垂直的,因此在更换样品过程中升高和降低棱镜时,总的内部反射区域会横向侧移很小。另外,常规的透射光技术(相衬,明场等)与此实验设计兼容。因为入射角固定为60度,所以普通的光学玻璃(折射率为1.52)不能支持全内反射,因此需要具有高折射率的棱镜。用火石玻璃制成的棱镜(折射率为1.64)将符合这些规格,并且是可商购的。然后,光束从棱镜进入盖玻片时会以法线折射角度为69度,从而超过盖玻片/缓冲液或盖玻片/细胞界面的临界角。梯形壁的角度在45至60度之间是理想的,但是这些单元不容易获得,必须按照定制规格进行制造。不幸的是,45度或60度梯形也不是可商购的,但是它们可以通过截短和抛光可商购三角棱镜的顶点而廉价地生产。梯形壁的角度在45至60度之间是理想的,但是这些单元不容易获得,必须按照定制规格进行制造。不幸的是,45度或60度梯形也不是可商购的,但是它们可以通过截短和抛光可商购三角棱镜的顶点而廉价地生产。梯形壁的角度在45至60度之间是理想的,但是这些单元不容易获得,必须按照定制规格进行制造。不幸的是,45度或60度梯形也不是可商购的,但是它们可以通过截短和抛光可商购三角棱镜的顶点而廉价地生产。
图5所示是利用抛物面镜和半球棱镜通过倒置显微镜进行TIRFM实验的第四种配置。在这种设计中,反射镜和棱镜的位置应使激光束朝着抛物面反射镜焦点处的全内反射物镜区域穿过棱镜的半径。由于光线在所有入射角处几乎垂直于脸部进入棱镜,因此与使用立方体或矩形棱镜块观察到的光束轮廓相比,光束轮廓的像差降低了。垂直入射激光束的横向偏移将始终聚焦在同一点上,从而可以对入射光角度进行实质性且方便的更改。此外,可以通过将入射光束分成两个分量来创建the逝场中的干涉条纹,它们分别在抛物线的一个单独的方位角位置反射,但在抛物线的焦点处重新组合。可以通过调节两个入射光束的相对方位角位置来改变条纹间隔,并且可以获得非常高的空间频率。干涉条纹可以通过创建平行线干涉条纹图案来辅助聚焦在界面上。可以在细胞/底物接触的荧光区域中观察到这种模式,这确认了激发源为van逝场(而不是光从细胞场随机散射)。干涉图样也可用于研究表面扩散速率,以测量接触区域中膜组件的横向迁移率。尽管该设计具有多功能性(图5),
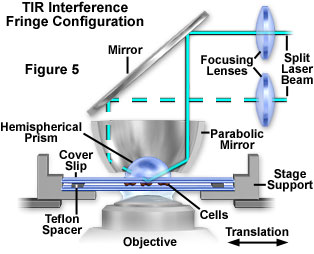
此处介绍的倒置显微镜TIRFM配置均具有一些优点和缺点。其中的主要优点是能够在显微镜载物台上利用价格便宜的光学元件以及足够的空间来放置样品和玻璃块/棱镜以及支撑光学组件。此外,棱镜可以安装在聚光镜支架上(在现代倒置显微镜的平台上方),以便于升高和降低,以及使用常规光学技术进行辅助观察。最后,这些光学装置设计简单,是最容易对准内部全反射的系统。
倒置显微镜配置的主要缺点之一是无法轻易从上方接近样品,而传统的照明受到棱镜顶点的阻碍。同样,最短的工作距离物镜可能无法在整个缓冲层上聚焦,并且当通过相对较厚的缓冲层查看样本时,由于球面像差,具有较高数值孔径物镜的图像质量会降低。
倒置显微镜系统与棱镜或玻璃块的对准涉及在样品清晰聚焦时将整个内部反射区域直接对准物镜。第一步是组装样品室和棱镜组合,然后使用明场照明(即使存在棱镜顶点的情况下)将样品聚焦。接下来,在卸下激光聚焦透镜的情况下,对准光束,使光束在物镜前透镜的中心上受到全内反射。可以通过直接(而不是通过显微镜目镜)观察棱镜,浸没层和基板中的散射入射光来观察。重新插入聚焦镜后,调整其位置,使聚焦的激光束进入棱镜侧面,距底部边缘约一毫米。直接观察光束应在棱镜底部显示三个共线的散射光点:两个在光束穿过浸没层的外侧,以及一个在样品上经历全内反射的中央点。应调整聚焦透镜,以使中间的斑点可见为细长的圆柱形区域。全内反射区域的位置和大小可以使用聚焦透镜平移器调节,也可以通过纵向移动透镜来优化照明区域的尺寸。其中两个位于光束穿过浸没层的外侧,另一个位于光束在样本上经历全内反射的中心点。应调整聚焦透镜,以使中间的斑点可见为细长的圆柱形区域。全内反射区域的位置和大小可以使用聚焦透镜平移器调节,也可以通过纵向移动透镜来优化照明区域的尺寸。其中两个位于光束穿过浸没层的外侧,另一个位于光束在样本上经历全内反射的中心点。应调整聚焦透镜,以使中间的斑点可见为细长的圆柱形区域。全内反射区域的位置和大小可以使用聚焦透镜平移器调节,也可以通过纵向移动透镜来优化照明区域的尺寸。
全内反射区域的形状取决于激光束进入的棱镜或玻璃块侧面的方向。如果侧面是垂直的(如块状或矩形),则该区域将被拉长到一定程度,这是光束会聚的函数。如前所述,伸长是由于在棱镜或玻璃块的第一表面上由大折射角引入的像差引起的。另一方面,如果侧面倾斜,使准直的激光束以接近垂直线的角度进入,则反射区域将类似于伸长程度较小的圆锥形截面,这是将圆柱光束切成一定角度所期望的。
在上述所有光学配置中,当在横向尺寸上扫描样本时,照明区域将在视场中心保持静止。但是,在聚焦过程中移动显微镜载物台时,取决于聚焦透镜和光束导向器是安装在实验室工作台上还是显微镜载物台上,照明区域可能会在样品聚焦时横向移动。
全内反射光斑应聚焦到不大于视野的宽度。如果斑点太大,则棱镜和盖玻片之间的浸油层的杂散散射和离焦荧光将增加TIRFM可能产生的低荧光背景。另一个伪影发生在非常接近临界最小值的入射角处,这可以通过沿界面表面的单元投射的明显阴影来体现。通过确保入射角超过临界角数度,可以避免这种情况。
当入射角接近临界值时,有时难以确定是否已实现全内反射。在这种情况下,通过显微镜目镜观察所得的荧光强度通常可以帮助研究者确定仪器的配置是否正确。TIRF界面的荧光发射与入射光束以亚临界“撇渣”角通过水性缓冲液传播时所激发的荧光完全不同。由于the逝波(与传播光束不同)比物镜聚焦深度浅得多,因此当被全内反射激发时,荧光似乎起源于单个平面。相反,
对于全内反射实验中的局部定性强度测量,可能希望限制从中收集发射光的区域。通常,被照射的面积不太可能很小,但是可以通过将可调光阑策略性地放置在发射光路中的图像平面上来获得定义的表面积。
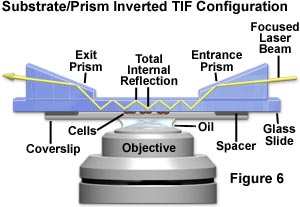
研究人员已采用了几种其他的涉及倒置显微镜的TIRFM配置。图6所示的系统提供了一种替代系统,该系统相对于样本而不是激光束固定棱镜。照明激光从右侧通过入射棱镜进入,然后折射到基板中,在基板中它通过多次内部反射向显微镜的光轴传播。一路上,多次反射的光束遇到标本(粘附在玻璃盖玻片上的组织培养细胞)并照亮玻璃/缓冲液界面区域的发色团。穿过样品和基板后,反射光束进入出射棱镜,该棱镜将光引向实验。在这种配置下,
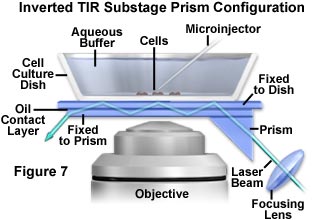
与同时进行显微注射或膜片钳实验兼容的更有用的配置如图7所示。为了使从上方轻松连续地进入浸入缓冲液中的组织培养物,将棱镜部署在载物台下方以接触基板玻璃。不能用于所有倒置显微镜的这种配置具有紧密的几何形状,因为物镜也位于附近区域。与图6中所示的系统类似,子棱镜在盖玻片中引发多次全内反射,从而将激发光作为波导从远轴转移到视场中心。
以最简单的形式,通过浸入油或甘油将一个小的三角棱镜(市售)放置在与含有细胞和缓冲液的盖玻片的底部光学接触。尽管在盖玻片的下侧可能会留下油污,这会破坏第一次内部反射(和实验),但可以在棱镜保持横向固定的同时平移样品。一种可行的替代方法是采用附加的中间盖玻片,该盖玻片通过光学透明胶固定在棱镜上。滑动发生在中间的盖玻片和细胞盖玻片之间,它们之间是光学接触的,并由一薄层浸入油或甘油润滑。这种配置的主要缺点是不能使用油或甘油浸没物镜,因为浸没介质可能会在形成照明点之前破坏内部反射。但是,在这些情况下,空气(干式)或水浸式物镜效果很好。
立式显微镜配置
可以将梯形棱镜与图4(b)中所示的类似,安装在立式显微镜的聚光镜支撑架上,以观察放置在样品台上的样品在全内反射界面处的现象(图8)。使用与透射光照明器相同的端口(应将其卸下)将扩展的激光束引入显微镜底座。放置在入口附近并安装在xy平移器上的长焦距(大约250毫米)会聚透镜用于聚焦入射激光束并允许对横向位置进行微调。然后,准直的激光照明可以利用显微镜的内置光学系统将光束引导通过底座,然后垂直向上进入棱镜。位于显微镜基座上方的额外镜头通常可用于平移和聚焦全内反射点。这种配置在调节入射角方面没有提供很大的灵活性,但是通过采用具有不同角度几何形状和折射率的几种梯形可以实现数值的有限范围。图像是通过图5所示的经过冷却的科学CCD数码相机收集的,但是可以很容易地替换光电倍增管或雪崩光电二极管。

棱镜玻璃的选择受到折射率要求的限制,火石玻璃(折射率为1.62)是首选配方。入射角为60度时,棱镜的折射率必须至少为1.53,以便在玻璃/水界面(不考虑基材)上发生全内反射。这就是为什么火石玻璃而不是普通的光学(皇冠)玻璃或熔融石英是这些实验的理想棱镜材料的原因。
照明激光被台下显微镜镜反射到棱镜中,并通过玻璃在棱镜的角边折射。因为按客户需要切成梯形的梯形棱镜无法从市场上买到,所以菱形截面是通过将易得的等边三角形棱镜的顶部截短并抛光而制成的。聚焦透镜被移除以定位激光轨迹,该聚焦透镜被调整为进入偏心的棱镜底部,在该底部其在倾斜侧进行全内反射并以60度的入射角朝向上表面前进。当将聚焦透镜插入光路时,光束会遵循相同的路线,但会变得更细,更强烈。
标本室可以是塑料培养皿或培养皿,放在显微镜载物台上进行观察。将一小滴浸入介质(甘油或油)放在棱镜的顶部,并通过抬高台下聚光镜架机构使其与培养室的下表面光学接触。然后,通过聚焦透镜平移器调整激光束的位置,以在腔室(或基板)的上表面进行全内反射,并沿着对称的方向朝棱镜的相反一侧的显微镜底部向下移动。该设置适用于多种类型的底物,但特别适合观察塑料培养皿底部生长的细胞。然后可以在原始接种细胞的同一腔室中观察细胞,而无需任何重新安装步骤。只要物镜具有足够的工作距离,研究人员就可以在直立显微镜下观察标本,从而用微量移液管,膜片钳和注射注射器同时探测细胞。
可以通过干燥,油浸或水浸物镜(倾析出大部分缓冲液后)通过盖玻片收集次级荧光发射,该盖玻片通过垫片悬浮在细胞单层表面上方。或者,可以将带有浸入锥的水浸物镜直接放入缓冲细胞中,以浸没细胞。直立显微镜的配置非常方便,因为标本可以像标准照明系统一样轻松互换。TIRF照明区域的位置也是固定的,并且即使在移动台显微镜上也不会受到聚焦的影响,这是现代立式显微镜设计的绝大部分。主要缺点是,入射照明角度无法在不切换到另一个具有不同倾斜角度的棱镜的情况下进行调节。
当将水浸物镜通过缓冲液直接浸没在未覆盖的培养皿或培养室中时,直立式系统可以提供高质量的图像,但是这种配置确实存在一些缺点。培养容器构造中使用的许多聚合物配方都有一定程度的自发荧光,这可能会降低弱荧光标本的对比度。如果未仔细选择浸没耦合介质,则可能会加重这种影响。几个浸没油的商业品牌也显示出不同水平的自发荧光,因此在将其用于TIRFM实验之前,研究人员应注意检查浸没油和塑料培养皿中是否存在潜在的荧光伪影。
对于大多数应用,可以使用普通的fl石光学玻璃制成棱镜,滑动片,腔窗和盖玻片,除非需要由较高的折射率引起的较短的穿透深度。光学玻璃不透射约310纳米以下的光,并且具有暗淡的自发光以及较长的衰减时间,这在某些光漂白实验中可能是一个问题。高质量熔融石英(石英)的自发光要低得多。更奇特的高折射率材料,例如蓝宝石,二氧化钛和钛酸锶,不会遭受高水平的自发荧光,并且不会产生比照明波长低一个数量级的渐逝场穿透深度。
荧光检测
与共聚焦和多光子显微镜不同,许多TIRFM图像可以类似于经典显微镜的方式记录在胶片上,而经典显微镜主要依赖于显微照相(明场,暗场,相差,微分干涉差等)。在某些情况下,尤其是当样本中仅存在少量荧光团时,建议使用更灵敏的成像设备,例如强度增强的摄像机,冷却的科学CCD,雪崩光电二极管或光电倍增管。在TIRFM实验中也可以使用延时电影摄影,并且可以使用上述任何设备捕获图像帧的序列,其选择取决于二次荧光的强度和获取图像所需的曝光时间。
当使用光电倍增管或雪崩光电二极管采集图像时,可以提供大量的多功能性。光电倍增管通常用于空间上无法解析但荧光强度的快速检测和定量。可变光圈和/或像平面光圈(如上所述)使研究者能够选择性地仅捕获完全可用视野的一部分。当在低光照水平下需要较长的采样间隔时,或者仅对部分视场感兴趣时,这很有用。选择用于图像采集的设备时,应考虑光电倍增管的光谱特性,并且这些特性应与要检查的荧光团的发射特性一致。
结论
通常,在具有可移动平台的显微镜上很难实现全内反射,因为焦点调整需要将激光束重新对准显微镜的焦平面和光轴。在选择用于TIRFM研究的显微镜时,请注意仪器的机械稳定性和构造图案。隔离桌上带有沉重镜架的倒置或直立显微镜将使研究人员能够为脆弱的van逝场建立相对无振动的环境。很难(最好)长时间保持聚焦的激光照明源在几微米的范围内,但只要将显微镜,激光源和支持的光学组件固定在适当的底座中并牢固地固定在工作台或显微镜台。
多种显微镜物镜设计与TIRFM实验兼容。唯一的绝对要求是物镜具有足够长的工作距离,以观察由间隔物厚度限定的缓冲溶液的细缝隙上的界面。特氟隆和氯丁橡胶垫片的厚度可以比任何标准物镜的工作距离薄,但仍远大于the逝场的穿透深度。这减少了无法聚焦在界面上的可能性,但是无法补偿由于样本/缓冲区域中的折射率变化而导致的潜在像差。在大多数高倍率物镜中,球面像差的校正主要取决于样品直接位于盖玻片的另一侧,而不是穿过额外的薄水层。结果可能是图像缺乏对比度,甚至在聚焦时也会产生模糊的图像。无法提供物镜规格的一般规则,但浸水物镜(浸入物镜或需要盖玻片的物镜)可能是最佳(也是最昂贵的)选择。另一方面,已经成功进行了TIRFM实验,其物镜是几乎所有商业上可获得的数值孔径和放大倍数。
在许多研究过程中,希望在通过全内反射进行的界面照明与通过经典落射荧光照明更深地渗透到样品主体之间的切换之间迅速切换。例如,瞬时过程可能涉及同时在膜和细胞质中的变化,但两者有所不同,这两者都必须记录下来。一些研究者已经描述了利用声光调制器的特殊设计的光电系统。这些配置由计算机控制,通常包含多个调制器,这些调制器可同步工作以在TIRF和落射荧光宽场之间振荡照明,同时使用光电倍增管或快速响应光电二极管设备收集数据。
用于TIRFM研究的玻璃表面支持细胞粘附力通常涂有特定的基材。二氧化硅表面的化学衍生物可以产生独特的物理和化学吸收特性,可用于调节模型膜和类似结构的形成。另外,某些特定化学物质的共价结合在细胞生物学和生物物理学中特别有用。通过将聚-L-赖氨酸附着到玻璃表面可以增强细胞粘附,并且可以用长链烃产生疏水表面以吸收脂质单层。可用于处理表面的选择性特异性的其他有用分子包括抗体,抗原,平面磷脂和凝集素。
可以淬灭荧光的铝薄层(大约20纳米)也可以通过标准真空蒸发法施加到玻璃表面。通过完全蒸发预定量的铝,可以精确控制沉积厚度。沉积后,铝膜的上表面在大气中自发氧化,产生氧化铝薄层。该氧化物涂层膜具有类似于二氧化硅的化学性质,并且可以以类似于玻璃的方式被有机硅烷衍生化。金属膜几乎完全淬灭那些在约10纳米内的荧光团的荧光的能力可以抑制来自非特异性吸附到基质的标记蛋白的信号。
与共聚焦显微镜不同,共聚焦显微镜通过用一组像平面针孔光阑排除离焦的发射光来产生光学切片,而TIRFM限于发生全内反射的玻璃/缓冲液界面数百纳米范围内的区域。 。共聚焦显微镜在多功能性方面具有明显的优势,因为光学切片可在样品的任何平面上进行,并且不限于不同折射率之间的界面。但是,TIRFM确实具有几个优势,包括更薄的光学部分(共焦大约为100纳米,而共焦大约为600纳米),与界面相邻的区域的选择性照明以及(相对便宜地)适应现有显微镜以利用以下优势的能力技术。